《2022屆高考化學(xué)三輪沖刺 對(duì)氧化還原反應(yīng)基本概念的考查導(dǎo)學(xué)案》由會(huì)員分享�,可在線閱讀,更多相關(guān)《2022屆高考化學(xué)三輪沖刺 對(duì)氧化還原反應(yīng)基本概念的考查導(dǎo)學(xué)案(6頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索���。
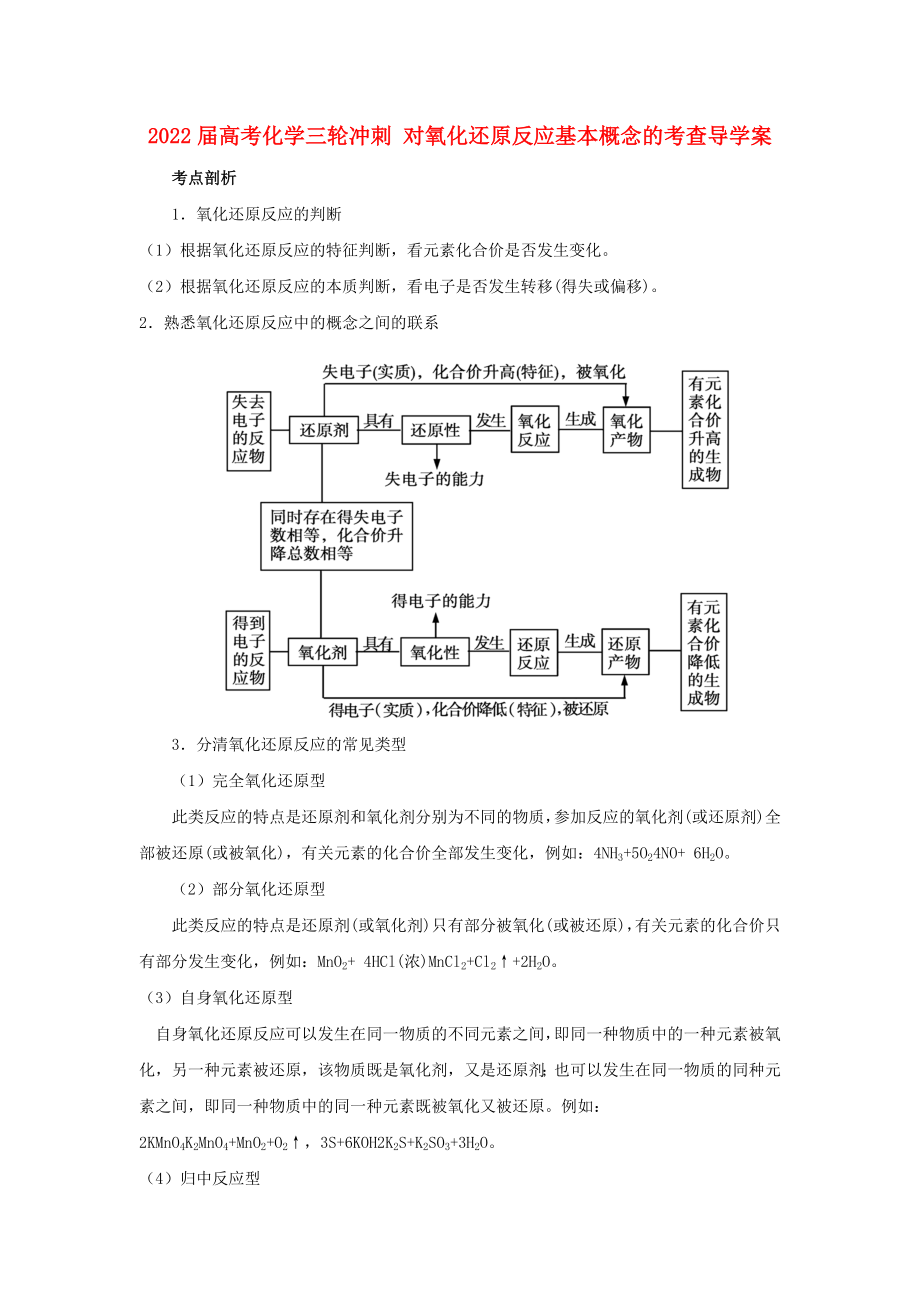
1�、2022屆高考化學(xué)三輪沖刺 對(duì)氧化還原反應(yīng)基本概念的考查導(dǎo)學(xué)案考點(diǎn)剖析1氧化還原反應(yīng)的判斷(1)根據(jù)氧化還原反應(yīng)的特征判斷���,看元素化合價(jià)是否發(fā)生變化��。(2)根據(jù)氧化還原反應(yīng)的本質(zhì)判斷��,看電子是否發(fā)生轉(zhuǎn)移(得失或偏移)���。2熟悉氧化還原反應(yīng)中的概念之間的聯(lián)系3分清氧化還原反應(yīng)的常見(jiàn)類型(1)完全氧化還原型此類反應(yīng)的特點(diǎn)是還原劑和氧化劑分別為不同的物質(zhì)���,參加反應(yīng)的氧化劑(或還原劑)全部被還原(或被氧化)���,有關(guān)元素的化合價(jià)全部發(fā)生變化��,例如:4NH3+5O24NO+ 6H2O��。(2)部分氧化還原型此類反應(yīng)的特點(diǎn)是還原劑(或氧化劑)只有部分被氧化(或被還原)��,有關(guān)元素的化合價(jià)只有部分發(fā)生變化��,例如:Mn
2���、O2+ 4HCl(濃)MnCl2+Cl2+2H2O。(3)自身氧化還原型自身氧化還原反應(yīng)可以發(fā)生在同一物質(zhì)的不同元素之間�,即同一種物質(zhì)中的一種元素被氧化,另一種元素被還原���,該物質(zhì)既是氧化劑���,又是還原劑�;也可以發(fā)生在同一物質(zhì)的同種元素之間�,即同一種物質(zhì)中的同一種元素既被氧化又被還原。例如: 2KMnO4K2MnO4+MnO2+O2���,3S+6KOH2K2S+K2SO3+3H2O���。(4)歸中反應(yīng)型此類反應(yīng)的特點(diǎn)是同一種元素在不同的反應(yīng)物中有不同的價(jià)態(tài)(高價(jià)、低價(jià))�,反應(yīng)后轉(zhuǎn)化成中間價(jià)態(tài)。例如:典例精析亞硝酸鹽中毒�,又名烏鴉病、紫紺病�、腸源性青紫病。亞硝酸鹽可將正常的血紅蛋白氧化成高鐵血紅蛋白�,血紅蛋
3、白中的鐵元素由二價(jià)變?yōu)槿齼r(jià)�,失去攜氧能力,使組織出現(xiàn)缺氧現(xiàn)象���。美藍(lán)是亞硝酸鹽中毒的有效解毒劑��。下列說(shuō)法中���,不正確的是( )A中毒時(shí)亞硝酸鹽發(fā)生氧化反應(yīng) B在中毒過(guò)程中血紅蛋白被氧化C藥品美藍(lán)應(yīng)具有還原性 D解毒時(shí)血紅蛋白被還原【答案】A【解析】A�、中毒時(shí)亞硝酸鹽可將正常的血紅蛋白氧化成高鐵血紅蛋白��,血紅蛋白被氧化時(shí)亞硝酸鹽被還原�,發(fā)生還原反應(yīng),而不是氧化反應(yīng)���,A錯(cuò)誤;B�、中毒時(shí)將正常的血紅蛋白氧化成高鐵血紅蛋白,血紅蛋白被氧化�,B正確C、美藍(lán)解毒就要使Fe3+轉(zhuǎn)化為Fe2+���,讓鐵元素發(fā)生還原反應(yīng)��,所以美藍(lán)是還原劑�,具有還原性�,C正確;D��、解毒時(shí)高鐵血紅蛋白被還原為正常血紅蛋白���,D正確��;答案選A
4�、。師精析:本題借助于亞硝酸鹽的性質(zhì)考查了氧化還原反應(yīng)的基本知識(shí)���。氧化反應(yīng)是物質(zhì)跟氧發(fā)生的化學(xué)反應(yīng)��,還原反應(yīng)是物質(zhì)失去氧的反應(yīng)�;在化學(xué)反應(yīng)中得到氧的物質(zhì)是還原劑���,失去氧的物質(zhì)是氧化劑�。亞硝酸鹽是強(qiáng)氧化劑又有還原性�,在空氣中會(huì)逐漸氧化,表面則變?yōu)橄跛徕c�,也能被氧化劑所氧化;遇弱酸分解放出棕色二氧化氮?dú)怏w��;與有機(jī)物�、還原劑接觸能引起爆炸或燃燒,并放出有毒的刺激性的氧化氮?dú)怏w���;遇強(qiáng)氧化劑也能被氧化��,特別是銨鹽��,如與硝酸銨���、過(guò)硫酸銨等在常溫下���,即能互相作用產(chǎn)生高熱,引起可燃物燃燒���。對(duì)點(diǎn)訓(xùn)練1下列化工生產(chǎn)過(guò)程中���,未涉及氧化還原反應(yīng)的是( )A侯式制堿法制純堿 B海帶提碘C電解飽和食鹽水制燒堿 D工業(yè)上合成
5���、氨【答案】A【解析】A�、反應(yīng)是NaClCO2NH3H2ONaHCO3NH4Cl��,2NaHCO3Na2CO3CO2H2O���,沒(méi)有涉及化合價(jià)的變化���,不屬于氧化還原反應(yīng)�,故正確���;B�、海帶中碘元素以化合態(tài)形式存在���,提取的碘是碘單質(zhì)�,涉及化合價(jià)的變化�,屬于氧化還原反應(yīng),故錯(cuò)誤��;C���、電解飽和食鹽水��,2NaCl2H2O2NaOHH2Cl2��,涉及化合價(jià)的變化��,屬于氧化還原反應(yīng)���,故錯(cuò)誤;D、N23H22NH3���,屬于氧化還原反應(yīng)�,故錯(cuò)誤���。2氮化鋁(化學(xué)式為AlN)廣泛應(yīng)用于電子���、陶瓷等工業(yè)領(lǐng)域。在一定條件下�,AlN可通過(guò)反應(yīng)Al2O3N23C2AlN3CO合成。下列敘述正確的是( )A上述反應(yīng)中�,N2是還原劑,Al
6��、2O3是氧化劑B上述反應(yīng)中���,每生成1 mol AlN需轉(zhuǎn)移3 mol eCAlN中氮元素的化合價(jià)為3DAlN的摩爾質(zhì)量為41 g【答案】B【解析】A�、該反應(yīng)中���,氧化劑氮?dú)猓€原劑是碳��,A錯(cuò)誤;B�、氮元素化合價(jià)從0價(jià)降低到3價(jià),每生成1 mol AlN需轉(zhuǎn)移3 mol電子�,B正確;C���、氮化鋁中氮元素的化合價(jià)是3價(jià)�,C錯(cuò)誤��;D���、氮化鋁的摩爾質(zhì)量是41 g/mol�,D錯(cuò)誤�;答案選B。3氰氨基化鈣(CaCN2)是一種重要的化工原料��,制備CaCN2的化學(xué)方程式為:CaCO3+2HCNCaCN2+CO+H2+CO2則在該反應(yīng)中A氫元素被氧化��,碳元素被還原BCaCN2是氧化產(chǎn)物��,H2為還原產(chǎn)物CHCN僅作氧
7���、化劑DCO為氧化產(chǎn)物���,H2為還原產(chǎn)物【答案】B【解析】AH元素化合價(jià)由+1價(jià)降低到0價(jià)�,被還原��,故A錯(cuò)誤���;B生成氫氣���,H元素化合價(jià)降低,H2為還原產(chǎn)物���,在HCN中碳為+2價(jià)�,CO中的碳也為+2價(jià)�,則CaCN2中的碳為+4價(jià),故CaCN2為氧化產(chǎn)物�,故B正確;C因HCN中的碳元素化合價(jià)升高�,氫元素的化合價(jià)降低,則HCN既是氧化劑又是還原劑��,故C錯(cuò)誤��;DHCN中碳為+2價(jià)���,CO中的碳也為+2價(jià)��,則CO不是氧化產(chǎn)物�,故D錯(cuò)誤�;故選B。4下列組合判斷正確的是( ) Cl2具有很強(qiáng)的氧化性��,在化學(xué)反應(yīng)中只能作氧化劑濃H2SO4有強(qiáng)氧化性���,常溫下能與Cu發(fā)生劇烈反應(yīng)化合反應(yīng)均為氧化還原反應(yīng)Cl2���、SO2均
8、能使品紅溶液褪色�,說(shuō)明二者均有氧化性Fe與稀HNO3、稀H2SO4反應(yīng)均有氣泡產(chǎn)生��,說(shuō)明Fe與兩種酸均發(fā)生置換反應(yīng)A不正確�,正確B正確,不正確C正確��,不正確D均不正確【答案】D【解析】Cl2既可作氧化劑���,又可作還原劑���,如Cl2和NaOH的反應(yīng)��;濃硫酸和Cu反應(yīng)需加熱��;有單質(zhì)參加的化合反應(yīng)才是氧化還原反應(yīng)��,如CaO+H2OCa(OH)2就不是氧化還原反應(yīng)��;SO2使品紅溶液褪色是因?yàn)镾O2有漂白性���;Fe與稀HNO3的反應(yīng)不是置換反應(yīng)。5向CuSO4溶液中逐滴加入KI溶液至過(guò)量��,觀察到有沉淀(CuI)生成���,且溶液變?yōu)樽厣?��,再向反?yīng)后的混合物中不斷通入SO2氣體,溶液逐漸變成無(wú)色��。下列有關(guān)分析中正確的
9���、是( )A上述實(shí)驗(yàn)條件下�,物質(zhì)的氧化性:Cu2+SO2I2B在SO2與I2反應(yīng)中得到的還原產(chǎn)物為H2SO4C通入SO2后溶液逐漸變成無(wú)色,體現(xiàn)了SO2的漂白性D滴加KI溶液時(shí)�,每轉(zhuǎn)移2 mol e會(huì)生成2 mol CuI沉淀【答案】D【解析】CuSO4溶液中逐滴加入KI溶液化學(xué)方程式為2CuSO4+4KI2K2SO4+2CuI+I2�,向反應(yīng)后的混合物中不斷通入SO2氣體,反應(yīng)方程式:SO2+2H2O+I2H2SO4+2HI�;A2CuSO4+4KI2K2SO4+2CuI+I2反應(yīng)中Cu2+化合價(jià)降低是氧化劑,I2是氧化產(chǎn)物���,氧化劑的氧化性強(qiáng)于氧化產(chǎn)物的氧化性���,所以物質(zhì)的氧化性:Cu2+I2,SO
10��、2+2H2O+I2H2SO4+2HI中碘元素化合價(jià)由0價(jià)降低為1價(jià)���,I2是氧化劑���,SO2被氧化,所以物質(zhì)氧化性I2SO2��,所以氧化性Cu2+I2SO2��,故A錯(cuò)誤��;B反應(yīng)后的混合物中不斷通入SO2氣體,反應(yīng)方程式:SO2+2H2O+I2H2SO4+2HI���,由反應(yīng)可知���,SO2被氧化,氧化產(chǎn)物為H2SO4��,故B錯(cuò)誤�;C向反應(yīng)后的混合物中不斷通入SO2氣體,反應(yīng)方程式:SO2+2H2O+I2H2SO4+2HI���,因?yàn)榘l(fā)生氧化還原反應(yīng)使碘褪色���,二氧化硫不表現(xiàn)漂白性,故C錯(cuò)誤�;DCuSO4溶液中逐滴加入KI溶液化學(xué)方程式為2CuSO4+4KI2K2SO4+2CuI+I2,由方程式可知每轉(zhuǎn)移2 mol電子生成
11��、2 mol CuI�,故D正確;故選D���。6已知在相同條件下進(jìn)行下列反應(yīng):Cl2+2KBr2KCl+Br2�;KClO3+6HCl3Cl2+KCl +3H2O;2KBrO3 +Cl2Br2 + 2KClO3�。下列說(shuō)法正確的是:( )A上述三個(gè)反應(yīng)都有單質(zhì)生成,所以都是置換反應(yīng) B反應(yīng)和反應(yīng)中均生成Br2���,溴元素發(fā)生的變化相同C反應(yīng)中被氧化與被還原物質(zhì)的物質(zhì)的量之比為61D中1 mol還原劑反應(yīng)則氧化劑得到電子的物質(zhì)的量為10 mol【答案】D【解析】A��、一種單質(zhì)與一種化合物反應(yīng)生成另一種單質(zhì)和另一種化合物的反應(yīng)為置換反應(yīng),反應(yīng)中生成兩種化合物��,不屬于置換反應(yīng)�,錯(cuò)誤;B��、反應(yīng)中Br元素的化合價(jià)從1價(jià)升
12��、高到0價(jià)���,被氧化�;反應(yīng)中Br元素的化合價(jià)從+5價(jià)降低到0價(jià)���,被還原��;溴元素發(fā)生的變化不同��,錯(cuò)誤�;C、反應(yīng)中���,6 mol HCl中只有5 mol被氧化��,則被氧化與被還原物質(zhì)的物質(zhì)的量之比為51���,錯(cuò)誤;D��、反應(yīng)中1 mol還原劑Cl2反應(yīng)失去10 mol電子���,則氧化劑得到電子的物質(zhì)的量為10 mol��,正確��。7ClO2是一種消毒殺菌效率高�、二次污染小的水處理劑��,實(shí)驗(yàn)室可通過(guò)以下反應(yīng)制得:2KClO3+H2C2O4+H2SO42ClO2+K2SO4+2CO2+2H2O據(jù)此��,下列說(shuō)法不正確的是( )AKClO3發(fā)生還原反應(yīng)BH2C2O4在反應(yīng)中被氧化CH2C2O4的氧化性強(qiáng)于ClO2的氧化性D1 mol
13、 ClO2生成�,該反應(yīng)轉(zhuǎn)移的電子數(shù)約為6.021023【答案】C【解析】ACl元素的化合價(jià)降低,得到電子被還原�,則KClO3發(fā)生還原反應(yīng),故A正確�;BC元素的化合價(jià)升高,失去電子被氧化��,則H2C2O4在反應(yīng)中被氧化�,故B正確;C該反應(yīng)中不能比較H2C2O4��、ClO2的氧化性�,故C錯(cuò)誤��;D由Cl元素的化合價(jià)變化可知��,每1 mol ClO2生成���,轉(zhuǎn)移1 mol(54)=1 mol電子��,即該反應(yīng)轉(zhuǎn)移的電子數(shù)約為6.021023��,故D正確�;故選C。8已知NH4CuSO3與足量的3 mol/L硫酸混合微熱���,產(chǎn)生下列現(xiàn)象:有紅色金屬生成��;產(chǎn)生刺激性氣味的氣體�;溶液呈現(xiàn)藍(lán)色�。據(jù)此判斷下列說(shuō)法錯(cuò)誤的是( )A
14、NH4CuSO3中只有Cu元素被氧化B反應(yīng)中硫酸作氧化劑C刺激性氣味的氣體是二氧化硫D1mol NH4CuSO3完全反應(yīng)轉(zhuǎn)移0.5 mol電子【答案】B【解析】NH4CuSO3與硫酸發(fā)生反應(yīng)的離子方程式是2NH4CuSO3+4H+Cu+Cu2+2SO2+2H2O+ 2�。A、由發(fā)生反應(yīng)方程式可知:只有Cu元素的化合價(jià)發(fā)生變化�,故A正確; B���、硫酸根反應(yīng)前后未變��,反應(yīng)中硫酸體現(xiàn)酸性�,故B錯(cuò)誤���;C��、因反應(yīng)是在酸性條件下進(jìn)行�,不可能生成氨氣���,所以刺激性氣味的氣體是二氧化硫�,故C正確;D���、只有Cu元素的化合價(jià)發(fā)生變化��,分別由+1+2��,+10���,由反應(yīng)的方程式可知:每2 mol NH4CuSO3參加反應(yīng)則轉(zhuǎn)
15、移1 mol電子�,則1 mol NH4CuSO3完全反應(yīng)轉(zhuǎn)移0.5 mol電子,故D正確�。9鐵在人體中的含量只有0.004%���,微乎其微���,但鐵是組成血紅蛋白的一個(gè)不可缺少的成員正二價(jià)鐵離子易被吸收,給貧血者補(bǔ)充鐵時(shí)���,應(yīng)給予含F(xiàn)e2的亞鐵鹽�,如硫酸亞鐵,服用維生素C�,可使食物中的Fe3還原成Fe2,有利于人體吸收(1)在人體中進(jìn)行Fe2Fe3的轉(zhuǎn)化時(shí)�,中的Fe2作劑。(2)“服用維生素C���,可使食物中的Fe3還原成Fe2”這句話指出��,維生素C在這一反應(yīng)中作_劑��。(3)用小蘇打片(NaHCO3)治療胃酸(主要成分鹽酸)過(guò)多的離子方程式為 ��;如果病人同時(shí)患有胃潰瘍�,此時(shí)最好服用胃舒平�,反應(yīng)的離子方程式為 ?��!敬鸢浮浚?)還原(2)還原(3)HCO2H2OAl(OH)33HAl33H2O【解析】(1)Fe2Fe3的轉(zhuǎn)化時(shí)��,中的Fe2作還原劑�,被氧化�,化合價(jià)升高;(2)維生素C做還原劑��,把Fe3還原成Fe2;(3)NaHCO3與鹽酸反應(yīng)的離子方程式為HCO2H2O��;Al(OH)3兩性氫氧化物���,與鹽酸反應(yīng)顯堿性:Al(OH)33HAl33H2O�。
 2022屆高考化學(xué)三輪沖刺 對(duì)氧化還原反應(yīng)基本概念的考查導(dǎo)學(xué)案
2022屆高考化學(xué)三輪沖刺 對(duì)氧化還原反應(yīng)基本概念的考查導(dǎo)學(xué)案