《人教版九年級化學(xué)下冊 雙減分層作業(yè)設(shè)計樣例 案例 第五單元 化學(xué)方程式 復(fù)習(xí)作業(yè)》由會員分享�,可在線閱讀,更多相關(guān)《人教版九年級化學(xué)下冊 雙減分層作業(yè)設(shè)計樣例 案例 第五單元 化學(xué)方程式 復(fù)習(xí)作業(yè)(6頁珍藏版)》請在裝配圖網(wǎng)上搜索�。
1、. .
4
4
2
2
2
2
4 2
. .
2 2
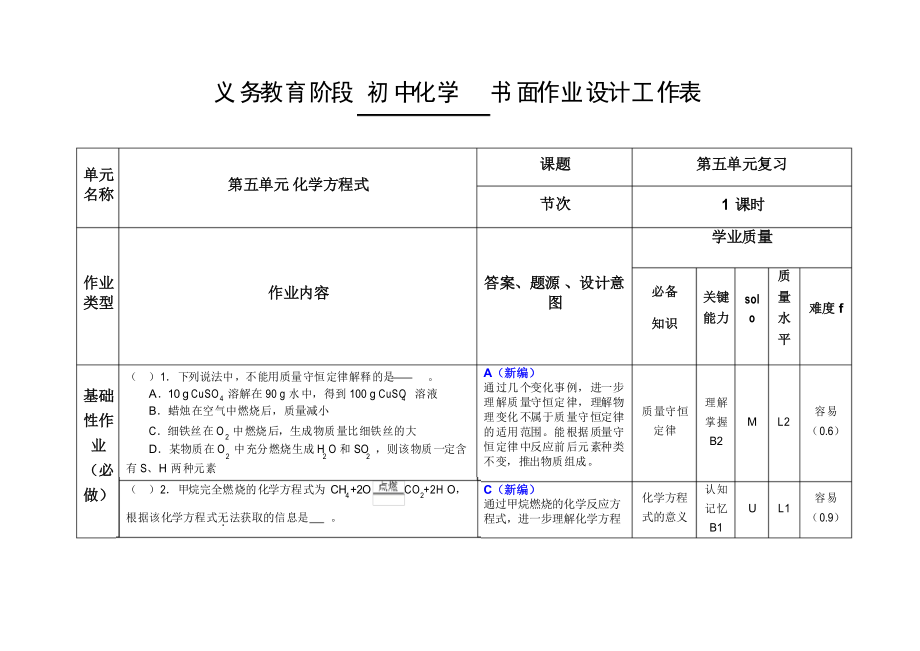
義務(wù)教育階段 初中化學(xué)
�
書面作業(yè)設(shè)計工作表
單元
名稱
�
第五單元 化學(xué)方程式
�
課題
節(jié)次
�
第五單元復(fù)習(xí)
1 課時
學(xué)業(yè)質(zhì)量
作業(yè)
類型
�
作業(yè)內(nèi)容
�
答案�、題源 、設(shè)計意
圖
�
必備
知識
�
關(guān)鍵
能力
�
sol
o
�
質(zhì)
量
水
�
難度 f
平
基礎(chǔ)
性作
業(yè)
(必
�
( )1.下列說法中�,不能用質(zhì)量守恒定律解釋的是 。 A
2�、.10 g CuSO 溶解在 90 g 水中,得到 100 g CuSO 溶液 B.蠟燭在空氣中燃燒后�,質(zhì)量減小
C.細(xì)鐵絲在 O 中燃燒后�,生成物質(zhì)量比細(xì)鐵絲的大
D.某物質(zhì)在 O 中充分燃燒生成 H O 和 SO �,則該物質(zhì)一定含 有 S、H 兩種元素
�
A(新編)
通過幾個變化事例�,進(jìn)一步 理解質(zhì)量守恒定律,理解物 理變化不屬于質(zhì)量守恒定律 的適用范圍�。能根據(jù)質(zhì)量守 恒定律中反應(yīng)前后元素種類 不變,推出物質(zhì)組成�。
�
質(zhì)量守恒
定律
�
理解
掌握
B2
�
M L2
�
容易
(0.6)
做)
�( )2.甲烷完全燃燒的化學(xué)方程式為 CH
3�、 +2O
根據(jù)該化學(xué)方程式無法獲取的信息是 。
�CO +2H O�,
�C(新編)
通過甲烷燃燒的化學(xué)反應(yīng)方 程式,進(jìn)一步理解化學(xué)方程
�
化學(xué)方程
式的意義
�認(rèn)知
記憶
B1
�
U L1
�
容易
(0.9)
2
4
2
2
2 4
2 2
2 5
2 2
2 2
. .
2 8 2 2 4
2 2
A.反應(yīng)物和生成物 C.反應(yīng)物的顏色和狀態(tài)
�
B.反應(yīng)所需條件
D.生成物的分子個數(shù)比
�
式的宏觀�、微觀意義?;瘜W(xué) 方程式無法表現(xiàn)出物質(zhì)的顏 色和狀態(tài)。
( )3.下列化學(xué)反應(yīng)方
4�、程式書寫正確的是 。
�B(新編)
A.Mg+O
B.2KMnO
C.4P+5O ↑
�
MgO
K MnO +MnO +O ↑ 2P O
�通過四個化學(xué)反應(yīng)�,辨析化 學(xué)方程式書寫正誤。進(jìn)一步 鞏固理解書寫化學(xué)方程式遵 循的兩個原則:①符合客觀 事實�;②遵守質(zhì)量守恒定 律。能正確標(biāo)注氣體符號
�
正確書寫
化學(xué)方程
式
�
理解
掌握
B2
�
M L2
�
容易
(0.8)
D.H O H ↑+O ↑
( )4.一定條件下�,甲、乙反應(yīng)生成丙的微觀示意圖如圖所示�, 下列說法錯誤的是 �。
A.反應(yīng)前后分子個數(shù)沒有改變
5�、B.該反應(yīng)屬于化合反應(yīng)
C.一個 X 分子中有 3 個原子
D.參加反應(yīng)的甲、乙質(zhì)量比為 7:4
( )5. 2020 年 11 月 6 日�,長征六號運載火箭成功將 NewSat9﹣18 衛(wèi)星送入預(yù)定軌道,提供動力的化學(xué)反應(yīng)為:
C H N +2N O ═3X+2CO +4H O�,下列說法正確的是 。
�
A(新編)
通過一氧化碳燃燒的反應(yīng) 微觀示意圖�,進(jìn)一步理解 質(zhì)量守恒定律的微觀解 釋,體會守恒觀的化學(xué)觀 念�,培養(yǎng)“宏微符”三重 表征的化學(xué)思維,提升學(xué) 生化學(xué)觀念與科學(xué)思維的 核心素養(yǎng)
A(新編)
通過火箭送衛(wèi)星入軌道的情 境�,運用質(zhì)量守恒定律,根 據(jù)反應(yīng)前后原子種類
6�、和數(shù)目
�
質(zhì)量守恒
定律的微
觀本質(zhì)
化學(xué)反應(yīng)
類型
質(zhì)量守恒
定律
�
理解
掌握
B2
認(rèn)知
記憶
B1
理解
掌握
B2
�
M L2
U L1
M L2
�
容易
(0.8)
容易
(0.9)
容易
(0.7)
不變的原則,推斷物質(zhì)的化
2
. .
A.X 的化學(xué)式為 N
B.反應(yīng)前后氮元素的化合價不變 C.生成物均為氧化物
D.該反應(yīng)屬于分解反應(yīng)
�
學(xué)式�。進(jìn)一步鞏固理解質(zhì)量 守恒定律;強化氧化物的概 念�,強化分解反應(yīng)概念
�
化合價的
計算
物質(zhì)
7、和反
應(yīng)的分類
�
模仿
應(yīng)用
B3
理解
掌握
B2
�
R L3
M L2
�
中等
(0.7)
容易
(0.8)
( )6.在化學(xué)反應(yīng) A+3B═2C+3D 中�,已知 8 g A 跟 0.3 g B 恰好完
�D(新編)
全反應(yīng)生成 2.7 g D。又知 B 的相對分子質(zhì)量為 2�,則 C 的相對分子 質(zhì)量為 。
A.18 B.28 C.40 D.56
�通過根據(jù)化學(xué)反應(yīng)中相對 分子質(zhì)量的計算�,進(jìn)一步掌 握根據(jù)化學(xué)方程進(jìn)行計算的 能力,深刻理解化學(xué)反應(yīng)中 質(zhì)量比等于相對分子質(zhì)量比 的質(zhì)量守恒定律,培養(yǎng)學(xué)生
�
根據(jù)化學(xué)
方
8�、程式的
簡單計算
�
模仿
應(yīng)用
B3
�
R L3
�
中等
(0.6)
守恒的化學(xué)觀念,提升學(xué)生 的計算能力�,發(fā)展學(xué)生化學(xué) 觀念的核心素養(yǎng)
( )7.甲、乙�、丙、丁四種物質(zhì)在密閉容器中反應(yīng)前后的質(zhì)量關(guān) 系如圖所示�,下列有關(guān)說法錯誤的是 。
A.x 的值是 19
B.丙可能是該反應(yīng)的催化劑
C.丁一定是化合物
D.反應(yīng)中甲和丁的質(zhì)量變化之比為 12:31
8.某化學(xué)學(xué)習(xí)小組在實驗室中用氯酸鉀和二氧化錳的混合物充分加 熱制取氧氣�,反應(yīng)過程中固體質(zhì)量變化如圖所示。求:
(1)該實驗中產(chǎn)生的氧氣的質(zhì)量為 g�。
�
A(新編)
通過坐標(biāo)柱狀圖的情
9、境�, 給出陌生反應(yīng)各物質(zhì)前后 質(zhì)量變化數(shù)據(jù)�,進(jìn)一步應(yīng) 用質(zhì)量守恒定律解決反應(yīng) 中的問題
�
質(zhì)量守恒
定律
催化劑的
特性
質(zhì)量守恒
定律
�
模仿
應(yīng)用
B3
理解
掌握
B2
理解
掌握
B2
�
R L3
M L2
M L2
�
中等
(0.6)
中等
(0.7)
容易
(0.8)
(2)原混合物中氯酸鉀的質(zhì)量分?jǐn)?shù)。(計 算結(jié)果精確到 0.1%)
(新編)
通過氯酸鉀制取氧氣的情 境�,結(jié)合圖像考查學(xué)生對 根據(jù)化學(xué)方程式進(jìn)行簡單
�
利用化學(xué)
方程式進(jìn)
行簡單計
算
�
10、模仿
應(yīng)用
B3
�
R L3
�
中等
(0.6)
計算的能力�,進(jìn)一步強化 化學(xué)計算的步驟,深刻理 解質(zhì)量守恒定律�,培養(yǎng)學(xué)生 守恒的化學(xué)觀念,提升學(xué)生 的計算能力�,發(fā)展學(xué)生化學(xué) 觀念的核心素養(yǎng)
拓展
性作
業(yè)
(選
做)
�( )1.將 15 克 A、24 克 B�、8 克 C 置于密閉容器中混合加熱, 充分反應(yīng)后容器中有 8 克 A 、 30 克 C�,還有一種物質(zhì) D。若 A�、 B、C�、D 的相對分子質(zhì)量依次為 28、32�、44、18�,則它們之間所 發(fā)生的化學(xué)方程式為 。
A.A+B=C+D B.A+2B=2C+D
C.A+3B=C+2
11�、D D.A+3B=2C+2D
�D(新編)
通過考查化學(xué)方程式的書 寫,進(jìn)一步鞏固化學(xué)方程式 的計算能力�,深刻理解質(zhì)量 比與相對分子質(zhì)量的關(guān)系, 培養(yǎng)學(xué)生的逆向思維能力�, 提升學(xué)生的計算能力,發(fā)展 學(xué)生守恒的化學(xué)觀念�,提升
�
根據(jù)化學(xué)
方程式的
簡單計算
�
模仿
應(yīng)用
B3
�
R L3
�
中等
(0.6)
學(xué)生化學(xué)觀念的核心素養(yǎng)
2
3 4
1
2
1
2
( )2.某物質(zhì)在純氧中完全燃燒,消耗 4.8 g 氧氣�,生成 2.7 g 水,同時生成 4.4 g 氣體�,將該氣體通入澄清石灰水中,石灰水變
�
A(新編
12�、)
通過物質(zhì)燃燒情境,能利用
渾濁�。該物質(zhì)中 。
A.一定含有 C、H�、O 三種元素
B.一定有 C、H 元素�,可能含有 O 元素 C.一定有 C、O 元素�,可能含有 H 元素
�質(zhì)量守恒定律結(jié)合反應(yīng)中各 物質(zhì)的質(zhì)量數(shù)據(jù),計算并推 斷出物質(zhì)組成�。進(jìn)一步鞏固 澄清石灰水檢驗二氧化碳的
�
質(zhì)量守恒
定律的應(yīng)
用
�
分析
評價
B4
�
E L4
�
較難
(0.4)
D.一定有 C 元素,可能含有 H�、O 元素
3. 某化學(xué)小組的同學(xué)設(shè)計了以下幾個實驗來驗證質(zhì)量守恒定律,請回 答問題�。
�知識點,強化對質(zhì)量守恒定 律的應(yīng)用�。
(1)A
13、BC (2)< (3)除 去鐵銹�; 析出紅色固體,溶
液由藍(lán)色變成淺綠色
�質(zhì)量守恒
(1)實驗 A﹣D 中不能用于直接驗證質(zhì)量守恒定律的是 (填
�
(4)3Fe+2O
Fe O �;
平衡裝置內(nèi)外壓強(新編) 通過探究實驗的情境�,進(jìn)一
�定律的驗
證實驗方
案、操
作�、現(xiàn)象
�理解
掌握
B2
�
M L2
�
中等
(0.7)
序號)。
�步理解質(zhì)量守恒定律的驗證
(2)實驗 A 中�,點燃前鎂條質(zhì)量為 m ,點燃后生成物質(zhì)量為 m �, 則 m m (選填“>”、“<”或“=”)。
(3)進(jìn)行實驗 D 時需提前對鐵釘進(jìn)
14�、行打磨的目的是 。將硫 酸銅溶液倒入燒杯�,燒杯中發(fā)生的實驗現(xiàn)象為 。 (4)實驗 E 中�,納米鐵粉在空氣中用激光手電稍微加熱即可劇烈燃 燒生成黑色固體,該反應(yīng)的化學(xué)方程式為 �,錐形瓶的雙 孔塞中插入一根一端綁有氣球的玻璃管,該氣球的作用是 �。
�實驗及適用范圍;理解有氣 體參加或生成的反應(yīng)需要在 密閉裝置中進(jìn)行才能驗證質(zhì) 量守恒定律�。能用質(zhì)量守恒 定律分析反應(yīng)前后固體物質(zhì) 質(zhì)量變化的原因。進(jìn)一步理 解密閉容器中化學(xué)反應(yīng)與氣 壓變化的關(guān)系�。提升學(xué)生科
�
質(zhì)量守恒
定律的驗
證實驗中
數(shù)據(jù)分析
及裝置作
用
�
分析
評價
B4
�
E L4
�
中等
(0.5)
學(xué)探究能力,發(fā)展學(xué)生探究 實驗和創(chuàng)新意識的核心素 養(yǎng)�。
 人教版九年級化學(xué)下冊 雙減分層作業(yè)設(shè)計樣例 案例 第五單元 化學(xué)方程式 復(fù)習(xí)作業(yè)
人教版九年級化學(xué)下冊 雙減分層作業(yè)設(shè)計樣例 案例 第五單元 化學(xué)方程式 復(fù)習(xí)作業(yè)