《(全國通用)2014屆高考化學一輪復習方案 課時作業(yè)(三十三) 第33講 綜合實驗與探究(含解析) 新人教版》由會員分享���,可在線閱讀���,更多相關《(全國通用)2014屆高考化學一輪復習方案 課時作業(yè)(三十三) 第33講 綜合實驗與探究(含解析) 新人教版(7頁珍藏版)》請在裝配圖網(wǎng)上搜索。
1���、課時作業(yè)(三十三) [第33講 綜合實驗與探究]
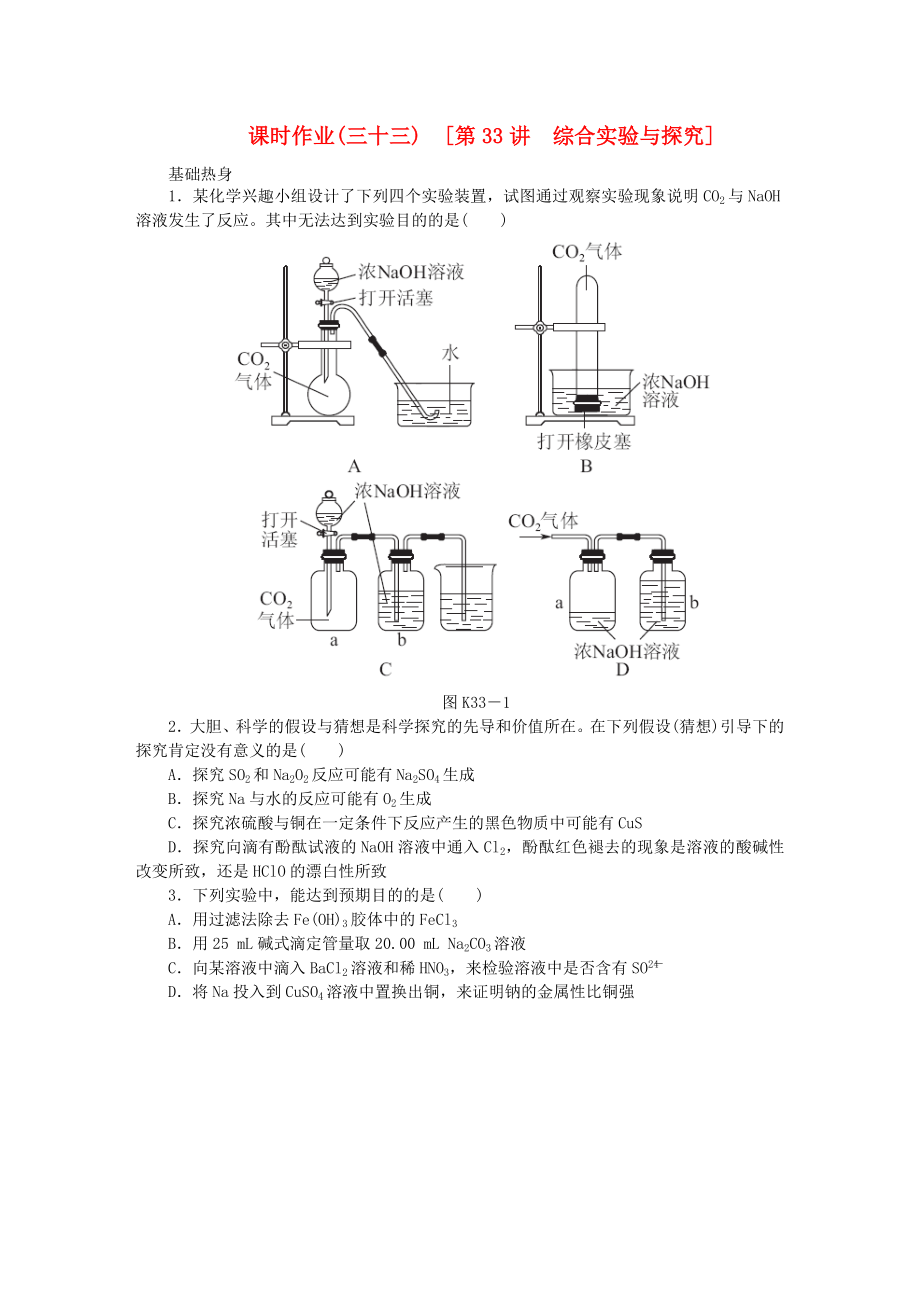
1.某化學興趣小組設計了下列四個實驗裝置���,試圖通過觀察實驗現(xiàn)象說明CO2與NaOH溶液發(fā)生了反應���。其中無法達到實驗目的的是( )
圖K33-1
2.大膽、科學的假設與猜想是科學探究的先導和價值所在���。在下列假設(猜想)引導下的探究肯定沒有意義的是( )
A.探究SO2和Na2O2反應可能有Na2SO4生成
B.探究Na與水的反應可能有O2生成
C.探究濃硫酸與銅在一定條件下反應產(chǎn)生的黑色物質(zhì)中可能有CuS
D.探究向滴有酚酞試液的NaOH溶液中通入Cl2���,酚酞紅色褪去的現(xiàn)象是溶液的酸堿性改變所致,還是HClO的漂白性所致
2���、
3.下列實驗中���,能達到預期目的的是( )
A.用過濾法除去Fe(OH)3膠體中的FeCl3
B.用25 mL堿式滴定管量取20.00 mL Na2CO3溶液
C.向某溶液中滴入BaCl2溶液和稀HNO3,來檢驗溶液中是否含有SO
D.將Na投入到CuSO4溶液中置換出銅���,來證明鈉的金屬性比銅強
圖K33-2
4.[2012·福州模擬] 小明同學在學習“硫酸及其鹽的某些性質(zhì)與用途”的過程中���,進行如下實驗探究。
[實驗一]探究濃硫酸的氧化性���,將實驗室常用的藥品放入如圖K33-2所示的實驗裝置后���,加熱裝置甲���。(夾持和加熱裝置省略)
(1)該裝置設計上存在明顯缺陷,請指出:_
3���、_______________________________________________________________________
________________________________________________________________________���。
(2)寫出裝置甲中反應的化學方程式:________________________________________________________________________
____________________________________________________________
4、____________���。
裝置乙中的試劑是________。
[實驗二]探究某硫酸亞鐵鹽固體是否變質(zhì)
(3)請你幫助小明同學完成如下實驗方案:
實驗操作
預期現(xiàn)象和結(jié)論
5.下列相關實驗不能達到預期目的的是( )
相關實驗
預期目的
A
相同溫度下���,等質(zhì)量的大理石塊���、大理石粉末分別與等體積、等濃度的鹽酸反應
探究接觸面積對化學反應速率的影響
B
把裝有顏色相同的NO2和N2O4混合氣的兩支試管(密封)分別浸入冷水和熱水中
探究溫度對化學平衡的影響
C
在蔗糖中加入稀硫酸���,水浴加熱���,再加入新制的氫氧化銅懸濁液并加熱
探究蔗
5���、糖水解產(chǎn)物具有還原性
D
兩支試管中裝有等體積、等濃度的H2O2溶液���,向其中一支試管中加入CuSO4溶液
探究CuSO4溶液對H2O2分解速率的影響
6.[2012·溫州十校聯(lián)考] 下列裝置所示的實驗不能達到目的的是( )
圖K33-3
7.[2012·杭州質(zhì)檢] 下列實驗設計能完成或?qū)嶒灲Y(jié)論合理的是( )
A.證明一瓶紅棕色氣體是溴蒸氣還是二氧化氮���,可用濕潤的碘化鉀淀粉試紙檢驗,觀察試紙顏色的變化
B.鋁熱劑溶于足量稀鹽酸再滴加KSCN溶液���,未出現(xiàn)血紅色���,鋁熱劑中一定不含鐵的氧化物
C.測氯水的pH,可用玻璃棒蘸取氯水點在pH試紙上���,待其變色后和標準比色卡比較
D
6���、.用新制氫氧化銅鑒別乙醇和乙酸
8.如圖K33-4表示從固體混合物中分離X的兩種方案,請根據(jù)方案1和方案2指出下列說法合理的是( )
圖K33-4
A.可以選用方案1分離碳酸氫鈉中含有的氯化銨
B.方案1中殘留物應該具有的性質(zhì)是受熱易揮發(fā)
C.方案2中加入的試劑一定能夠與除X外的物質(zhì)發(fā)生化學反應
D.方案2中加入NaOH溶液可以分離出SiO2和Fe2O3混合物中的Fe2O3
9.[2012·長春調(diào)研] 為測定某碳酸氫鈉樣品純度(含有少量氯化鈉)���,學生設計了如下幾個實驗方案(每個方案均稱取m1 g樣品)���,請回答每個方案中的問題���。
[方案Ⅰ]選用重量法進行測定:可用圖K33-
7、5中的裝置進行實驗���。
圖K33-5
(1)A裝置中NaOH溶液的作用是________________________________________________________________________���,
若直接向試樣溶液中鼓入空氣會導致實驗測定結(jié)果________(填“偏高”“偏低”或“無影響”)。
(2)該方案需直接測定的物理量是________________________________________________________________________���。
[方案Ⅱ]選用氣體體積法進行測定:可用如圖K33-6中的裝置進行實驗���。
圖K33-6
8、
(3)為了減小實驗誤差���,量氣管中加入的液體X為________溶液。
(4)通過實驗���,測得該試樣中碳酸氫鈉質(zhì)量分數(shù)偏低���,產(chǎn)生這種現(xiàn)象的原因可能是________���。
a.測定氣體體積時未冷卻至室溫
b.測定氣體體積時水準管的液面高于量氣管的液面
c.Y型管中留有反應生成的氣體
d.氣體進入量氣管前未用濃硫酸干燥
[方案Ⅲ]選用滴定法進行測定:
(5)稱取m1 g樣品,配成100 mL溶液���,取出20 mL���,用c mol·L-1的標準HCl溶液滴定,消耗體積為V mL���,則該試樣中碳酸氫鈉質(zhì)量分數(shù)的計算式為________���。
10.某興趣小組成員發(fā)現(xiàn)在超市購買的“旺
9、旺雪餅”袋內(nèi)有一個小紙袋���,上面寫著“干燥劑���,主要成分是生石灰,請勿食用”���。該興趣小組對干燥劑的有關問題進行相關探究:
(1)問題1:為什么生石灰(CaO)可作干燥劑���?(用化學方程式表示)________________________________________________________________________
________________________________________________________________________���。
(2)興趣小組甲同學又對它作了一系列探究,其有關實驗方案如下:
問題與猜想
實驗步驟
實驗現(xiàn)象
實驗結(jié)
10���、論
問題2:小紙袋中的物質(zhì)能否繼續(xù)作干燥劑���?
取足量小紙袋中固體放入燒杯中,加入適量水���,觸摸杯壁
不能繼續(xù)作干燥劑
問題3:甲猜想變質(zhì)后的物質(zhì)可能含有碳酸鈣���,該如何驗證甲的猜想?
該干燥劑樣品中含有碳酸鈣
(3)問題4:樣品中碳酸鈣的含量如何���?乙同學按如下流程進行實驗:用鹽酸溶解該干燥劑樣品→干燥所得氣體→用NaOH溶液吸收氣體→根據(jù)NaOH溶液的增重計算該樣品的含量���,實驗過程中所取該干燥劑樣品的質(zhì)量為10.0 g。實驗裝置如圖K33-7所示���。
圖K33-7
①A為溶解該干燥劑樣品的裝置,若已準備了長頸漏斗���、雙孔橡膠塞���、導氣管���,為完成溶解至少還需要的實驗儀器是_
11、_______���。
②A中發(fā)生反應的化學方程式為________________________________________________________________________
________________________________________________________________________���。
③將插入溶液C中管子的下端改成具有多孔的球泡(如圖中的D),有利于提高實驗的準確度���,其理由是________________________________________________________________________________���。
12、
④當改進實驗裝置并進行正確操作后可以準確測定出干燥劑樣品的含量(假設生成氣體沒有損失���,并完全吸收)���。若此時C裝置在實驗前后其質(zhì)量增加了3.6 g,則該干燥劑樣品中CaCO3的百分含量為________________________________________________________________________���。
課時作業(yè)(三十三)
1.D
2.B [解析] 因為H2O中O若變成O2���,則氧元素價態(tài)升高���,水是還原劑,但單質(zhì)鈉只能作還原劑���。
3.B [解析] 膠體和溶液都能夠透過濾紙���,A錯;HNO3能夠?qū)O氧化為SO而帶來干擾���,也可能有Ag+的干擾���,C錯;Na非?��;顫?/p>
13���、,投入到CuSO4溶液中與水劇烈反應,不能置換出Cu���。
4.(1)裝置乙中的廣口瓶不應加瓶塞
(2)Cu+2H2SO4(濃)CuSO4+SO2↑+2H2O或C+2H2SO4(濃)CO2↑+2SO2↑+2H2O(或其他合理答案也可) NaOH溶液
(3)實驗操作:往一支試管中加入少量固體樣品,加水溶解���,再滴加幾滴KSCN溶液 預期現(xiàn)象和結(jié)論:若溶液變?yōu)榧t色���,說明該固體已變質(zhì);若溶液未變?yōu)榧t色���,說明該固體沒有變質(zhì)
[解析] (1)制氣裝置不能在封閉體系中進行���,否則易引起爆炸,因此尾氣吸收裝置乙中的廣口瓶不能加瓶塞���。(2)根據(jù)品紅溶液可推測發(fā)生裝置中生成了SO2氣體���,因此可選用Cu與濃硫酸反
14、應或C與濃硫酸反應���。(3)檢驗硫酸亞鐵鹽固體是否變質(zhì)即檢驗樣品中有無Fe3+���,檢驗Fe3+最靈敏的試劑是KSCN溶液���。
5.C [解析] C項,蔗糖中加入稀H2SO4���,水浴加熱后應加入NaOH中和過量的稀H2SO4���,再加新制的Cu(OH)2懸濁液并加熱。
6.A [解析] A項使用長頸漏斗無法收集到氣體���;B項可通過U形管中紅墨水液面的變化來說明試管內(nèi)氣體壓強的變化���,進而證明Na與H2O反應的熱效應;C項在小試管內(nèi)看到渾濁(有S生成)即可證明氧化性:KMnO4���、Cl2���、S依次減弱;D項操作因NH4Cl受熱易分解成HCl與NH3���,HCl與NH3在燒瓶上又會重新化合生成NH4Cl���,從而達到分離S
15���、iO2與NH4Cl的目的。
7.D [解析] 溴蒸氣���、二氧化氮均具有強氧化性,均能使?jié)駶櫟牡饣浀矸墼嚰堊兯{���,無法區(qū)別���;鋁熱劑溶于足量稀鹽酸后,可能發(fā)生反應:Al+3Fe3+===3Fe2++Al3+���,再滴加KSCN溶液���,不會出現(xiàn)血紅色,所以此方法不能檢驗鋁熱劑中是否含鐵的氧化物���;氯水有強氧化性���,能使pH試紙褪色,所以用pH試紙不能測量氯水的pH;乙酸能與Cu(OH)2反應���,故可根據(jù)沉淀是否溶解鑒別乙醇和乙酸���。
8.D [解析] 碳酸氫鈉加熱分解,A錯誤���;加熱后留下的殘留物一定是固體或難揮發(fā)的液體���,B錯誤;加入的試劑可以是水且不一定發(fā)生化學反應���,C錯誤���;二氧化硅能與氫氧化鈉溶液反應生成溶于
16、水的硅酸鈉���,進而分離出氧化鐵���,D正確。
9.(1)吸收空氣中的CO2 偏高
(2)裝置C反應前后的質(zhì)量
(3)飽和NaHCO3(其他合理答案也可)
(4)b
(5)×100%
[解析] (1)本題是通過碳酸氫鈉與硫酸反應生成二氧化碳���,再用堿石灰吸收二氧化碳���,通過二氧化碳的質(zhì)量求碳酸氫鈉的質(zhì)量分數(shù)���,故應排除空氣中二氧化碳的干擾,若不吸收空氣中的二氧化碳會導致測定結(jié)果偏高���。
(2)需要直接測定的物理量是裝置C反應前后的質(zhì)量���,其質(zhì)量差即為二氧化碳的質(zhì)量���。
(3)二氧化碳能溶于水���,用飽和碳酸氫鈉溶液可以降低二氧化碳的溶解度,減小實驗誤差���。
(4)a項會使測定結(jié)果偏高���;b項氣體壓強大于
17、大氣壓���,會使測定的體積偏小���,導致碳酸氫鈉的測定結(jié)果偏低���;c項,原Y形管內(nèi)有空氣���,后留有反應產(chǎn)生的氣體不影響實驗結(jié)果���;本題是用排水集氣法測定氣體體積,不需要干燥���,d項無影響���。
(5)根據(jù)化學方程式:NaHCO3+HCl===NaCl+CO2↑+H2O,可知反應消耗的鹽酸與碳酸氫鈉的物質(zhì)的量相等���,w(NaHCO3)=×100%���。
10.(1)CaO+H2O===Ca(OH)2
(2)不發(fā)燙 取該固體,滴加稀鹽酸 有氣泡產(chǎn)生
(3)①錐形瓶或廣口瓶?��、贑aCO3+2HCl===CaCl2+CO2↑+H2O?��、墼龃髿怏w和溶液的接觸面積���,有利于二氧化碳的吸收 ④81.8%
[解析] (1)作干燥劑要能吸收水蒸氣���,故反應為CaO+H2O===Ca(OH)2���;(2)因為CaO溶于水會放出大量的熱,根據(jù)結(jié)論不能再作干燥劑���,所以現(xiàn)象為杯壁不發(fā)燙;如果是CaCO3���,則可以加鹽酸看是否有氣泡產(chǎn)生即可���。(3)從所給的儀器看缺少盛放樣品的容器,可選用錐形瓶等���,A中的反應為CaCO3+2HCl===CaCl2+CO2↑+H2O���,多孔的球泡有利于CO2的吸收���,C裝置增重是吸收了CO2,即CO2為0.0818 mol���,相當于CaCO3為8.18 g���,百分含量為81.8 %。
 (全國通用)2014屆高考化學一輪復習方案 課時作業(yè)(三十三) 第33講 綜合實驗與探究(含解析) 新人教版
(全國通用)2014屆高考化學一輪復習方案 課時作業(yè)(三十三) 第33講 綜合實驗與探究(含解析) 新人教版