《高中化學(xué) 專題4 分子空間結(jié)構(gòu)與物質(zhì)性質(zhì) 4.2 配合物的形成教案 蘇教版選修3》由會員分享����,可在線閱讀,更多相關(guān)《高中化學(xué) 專題4 分子空間結(jié)構(gòu)與物質(zhì)性質(zhì) 4.2 配合物的形成教案 蘇教版選修3(6頁珍藏版)》請在裝配圖網(wǎng)上搜索����。
1����、
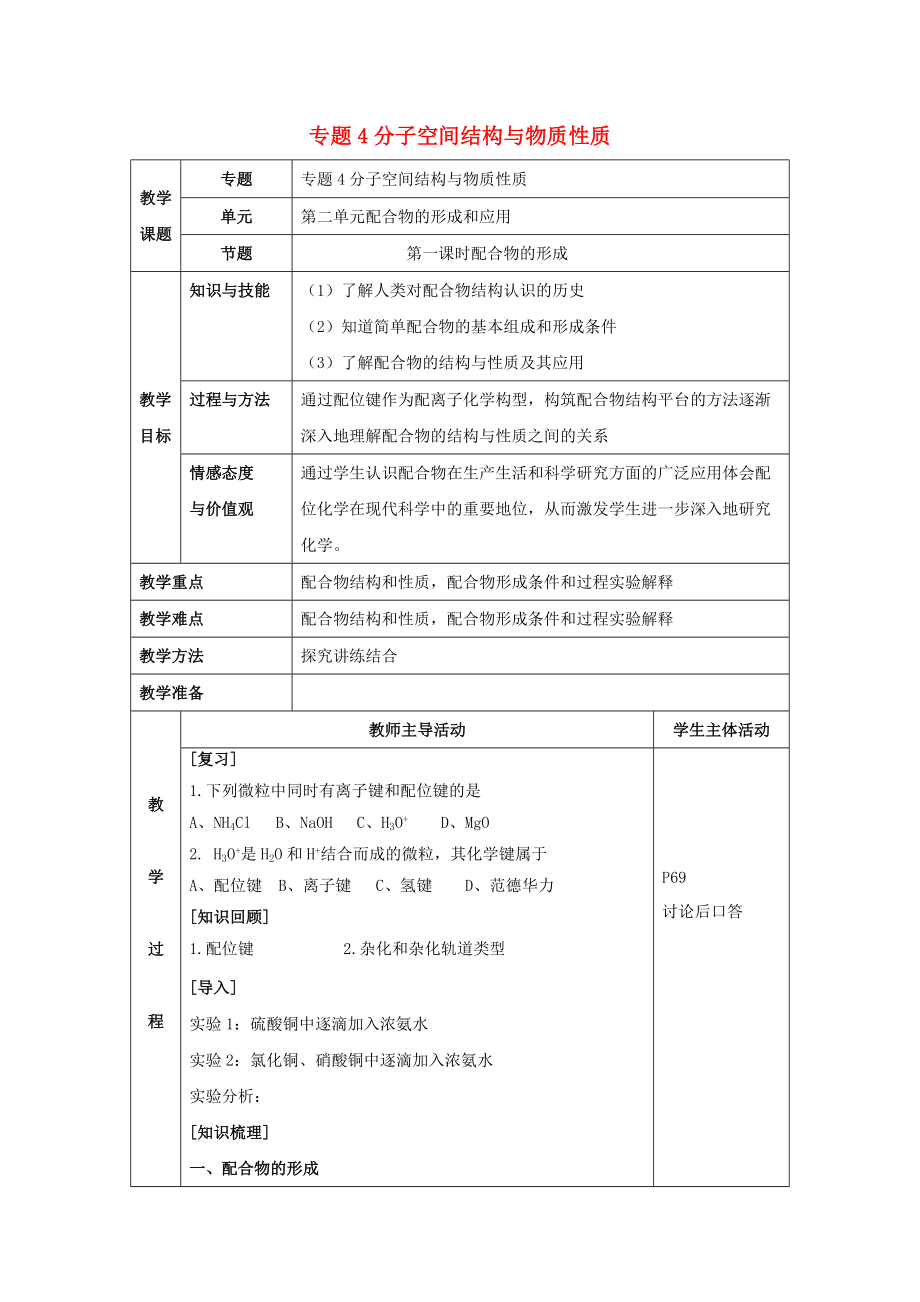
專題4分子空間結(jié)構(gòu)與物質(zhì)性質(zhì)
教學(xué)
課題
專題
專題4分子空間結(jié)構(gòu)與物質(zhì)性質(zhì)
單元
第二單元配合物的形成和應(yīng)用
節(jié)題
第一課時配合物的形成
教學(xué)目標(biāo)
知識與技能
(1)了解人類對配合物結(jié)構(gòu)認(rèn)識的歷史
(2)知道簡單配合物的基本組成和形成條件
(3)了解配合物的結(jié)構(gòu)與性質(zhì)及其應(yīng)用
過程與方法
通過配位鍵作為配離子化學(xué)構(gòu)型����,構(gòu)筑配合物結(jié)構(gòu)平臺的方法逐漸深入地理解配合物的結(jié)構(gòu)與性質(zhì)之間的關(guān)系
情感態(tài)度
與價值觀
通過學(xué)生認(rèn)識配合物在生產(chǎn)生活和科學(xué)研究方面的廣泛應(yīng)用體會配位化學(xué)在現(xiàn)代科學(xué)中的重要地位,從而激發(fā)學(xué)生進(jìn)一步深入地研究化學(xué)����。
2����、
教學(xué)重點
配合物結(jié)構(gòu)和性質(zhì),配合物形成條件和過程實驗解釋
教學(xué)難點
配合物結(jié)構(gòu)和性質(zhì)����,配合物形成條件和過程實驗解釋
教學(xué)方法
探究講練結(jié)合
教學(xué)準(zhǔn)備
教
學(xué)
過
程
教師主導(dǎo)活動
學(xué)生主體活動
[復(fù)習(xí)]
1.下列微粒中同時有離子鍵和配位鍵的是
A、NH4Cl B����、NaOH C、H3O+ D����、MgO
2. H3O+是H2O和H+結(jié)合而成的微粒����,其化學(xué)鍵屬于
A����、配位鍵 B、離子鍵 C����、氫鍵 D、范德華力
[知識回顧]
1.配位鍵 2.雜化和雜化軌道類型
[導(dǎo)入]
實驗1:硫酸銅中逐滴
3����、加入濃氨水
實驗2:氯化銅、硝酸銅中逐滴加入濃氨水
實驗分析:
[知識梳理]
一����、配合物的形成
1、配合物:由提供孤電子對的配體與接受孤電子對的中心原子以配位鍵結(jié)合形成的化合物稱為配位化合物簡稱配合物����。
P69
討論后口答
觀察
理解
教
學(xué)
過
程
教師主導(dǎo)活動
學(xué)生主體活動
2、配合物的組成
從溶液中析出配合物時����,配離子經(jīng)常與帶有相反電荷的其他離子結(jié)合成鹽����,這類鹽稱為配鹽����。配鹽的組成可以劃分為內(nèi)界和外界。配離子屬于內(nèi)界����,配離子以外的其他離
4、子屬于外界����。內(nèi)����、外界之間以離子鍵結(jié)合。外界離子所帶電荷總數(shù)等于配離子的電荷數(shù)����。
(1)中心原子:通常是過渡金屬元素(離子和原子),少數(shù)是非金屬元素����,例如:Cu2+����,Ag+����,F(xiàn)e3+,F(xiàn)e����,Ni,BⅢ����,PⅤ……
(2)配位體:含孤電子對的分子和離子。如: F-����,Cl-,Br-����,
I-,OH-����, CN-����,H2O����,NH3,CO ……
配位原子:配位體中具有孤電子對的原子����。如:C、N����、O、F����、Cl����、S等。
(3)配位數(shù):向中心原子提供孤電子對的原子數(shù)目����。如:[Ag(NH3)2]+中配位數(shù)為2
(4)配離子的電荷數(shù):中心原子與配位體總電荷數(shù)代數(shù)和����。
3����、配合物形成的條件和過程
條件:①
5、一個原子有孤電子對 ②另一原子有接受孤電子對的空軌道
過程:
4����、 配合物的簡單命名
主要是配離子的命名,配位體與中心原子間用“合”相連����。
如:[Ag(NH3)2]+ —— 二氨合銀離子,
[Zn(NH3)4]SO4—— 硫酸化四氨合鋅
[Co(NH3)6]Cl3—— 三氯化六氨合鈷
K3[Fe(SCN)6]—— 六氰合鐵酸鉀
[小結(jié)]:配合物的組成與形成條件
板書
一����、配合物的形成
1、配合物:
2����、配合物的組成
(1)中心原子 (2)配位體
(3)配位數(shù) (4)配離子電荷數(shù)
3、配合物
6、的形成條件與過程
4����、配合物的簡單命名
練習(xí)
一、選擇題
1.銨根離子中存在的化學(xué)鍵類型按離子鍵����、共價鍵和配位鍵分類,應(yīng)含有 ( )
A.離子鍵和共價鍵 B.離子鍵和配位鍵
C.配位鍵和共價鍵 D.離子鍵
2.對于配合物中位于中心位置的中心形成體的正確說法是( )
A.一般是金屬陽離子
B.一般是金屬陽離子,中性原子,也可以是非金屬陽離子或陰離子
C.只能是金屬陽離子
D.以上幾種說法都對
3.下列分子或離子中����,能提供孤對電子與某些金屬離子形成配位鍵的是( )
①H2O ②NH3 ③F— ④C
7、N— ⑤CO
A.①② B.① ②③ C.①②④ D.①②③④⑤
4.在CuCl2溶液中存在如下平衡:下列說法中不正確的是 ( )
[CuCl4]2-+4H2O===[Cu(H2O)4]2++4Cl-
綠色 藍(lán)色
A.將CuCl2固體溶于少量水中得到綠色溶液
B.將CuCl2固體溶于大量水中得到藍(lán)色溶液
C.[CuCl4]2-和[Cu(H2O)4]2+都是配離子
D.從上述平衡可以看出[Cu(H2O)4]2+比[CuCl4]2-穩(wěn)定
5.氣態(tài)氯化鋁(A
8����、l2Cl6)是具有配位鍵的化合物,分子中原子間成鍵的關(guān)系如圖所示����。若將圖中是配位鍵的斜線上加上箭頭,下列4個選項中正確的是 ( )
6.向盛有硫酸銅水溶液的試管里加入氨水����,首先形成難溶物,繼續(xù)添加氨水����,難溶物溶解得到深藍(lán)色的透明溶液。下列對此現(xiàn)象說法正確的是 ( )
A.反應(yīng)后溶液中不存在任何沉淀����,所以反應(yīng)前后Cu2+的濃度不變。
B.沉淀溶解后����,將生成深藍(lán)色的配合離子[Cu(NH3)4] 2+。
C.向反應(yīng)后的溶液加入乙醇����,溶液將會沒有發(fā)生變化,因為[Cu(NH3)4] 2+����。不會與乙醇發(fā)生反應(yīng)。
D.在[[Cu(NH3)4] 2+����。離子中,Cu2+給出孤對電子
9����、,NH3提供空軌道。
二����、填空題
7.向試管中加入2mL5%的硫酸銅溶液,逐滴加入過量的氨水����,邊滴加邊振蕩。
⑴請寫出有關(guān)化學(xué)方程式:
① ②
⑵[Zn(NH3)4]SO4中����,Zn2+與NH3以 相結(jié)合,形成配合物的內(nèi)界 ����, 為配合物的外界。Zn2+接受4個NH3分子中氮原子提供的孤電子對����,形成 個配位鍵,Zn2+提供4個空
10����、 雜化軌道接受孤電子對是 ,NH3分子中氮原子提供孤電子對����,是配位原子����,NH3分子是 ����,[Zn(NH3)4]2+中����,Zn2+的配位數(shù)是 。
8.配位鍵形成的條件: 一個原子有 ����,另一個原子有接受孤電子對的 。
中心原子:具有接受 的原子或離子����,多為 的離子。
配位體:提供孤電子對的分子或離子����;其中 的原子叫配位原子,常見的配位原子有 等
9
11����、.某物質(zhì)的實驗式PtCl42NH3����,其水溶液不導(dǎo)電����,加入AgNO3也不產(chǎn)生沉淀,以強(qiáng)堿處理并沒有NH3放出����,試推測其化學(xué)式。指出其中心原子����,配位體及配位數(shù)。
10.向AgNO3溶液中滴加氨水至沉淀溶解可形成[Ag(NH3)2]+配離子����。Ag+空的 軌道和 軌道可以形成 雜化軌道。NH3分子中N原子有 對孤電子對����,N原子上的孤電子對進(jìn)入Ag+空的 雜化軌道形成配位鍵。Ag+有 個空的 雜化軌道����,可以接受2個NH3分子提供的孤電子對����,形成 型的[Ag
12����、(NH3)2]+����。
11.⑴硝酸銀溶液中分別滴加NaOH溶液,氯化銨溶液����,都會立即產(chǎn)生沉淀,有關(guān)化學(xué)方程式是 ����。⑵如果把它們?nèi)咭砸欢ǖ臐舛缺然旌希玫降膮s是澄清透明的溶液����,相關(guān)的反應(yīng)方程式是 。
12.試比較明礬[KAl(SO4)212H2O]與硫酸四氨合銅[Cu(NH3)4]SO4兩者的區(qū)別:
⑴兩者的電離方程式是:
⑴
13����、
⑵這兩者屬類別是:明礬屬 ����;硫酸四氨合銅
�參考答案
一����、選擇題
1.C 2.B 3.D 4.D 5.D 6.B
二、填空題
8.配位鍵形成的條件: 一個原子有孤電子對����,另一個原子有接受孤電子對的空軌道。
中心原子:具有接受孤電子對的原子或離子����,多為過渡金屬元素的離子。
配位體:提供孤電子對的分子或離子����;其中提供孤電子對的原子叫配位原子,常見的配位原子有鹵素原子(X)����、O、S����、N����、P等
10. 5s����;5p; sp����; 1����;sp; 2����; sp; 直線����。
11.⑴Ag++OH-=AgOH↓ 2AgOH=Ag2O↓+H2O Ag++Cl-=AgCl↓
⑵AgNO3+2NH4Cl+2NaOH =[Ag(NH3)2]Cl +NaNO3+NaCl+2H2O
6EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F375
 高中化學(xué) 專題4 分子空間結(jié)構(gòu)與物質(zhì)性質(zhì) 4.2 配合物的形成教案 蘇教版選修3
高中化學(xué) 專題4 分子空間結(jié)構(gòu)與物質(zhì)性質(zhì) 4.2 配合物的形成教案 蘇教版選修3