《高中化學(xué) 專題4 分子空間結(jié)構(gòu)與物質(zhì)性質(zhì) 4.2 配合物的應(yīng)用教案 蘇教版選修3》由會員分享��,可在線閱讀����,更多相關(guān)《高中化學(xué) 專題4 分子空間結(jié)構(gòu)與物質(zhì)性質(zhì) 4.2 配合物的應(yīng)用教案 蘇教版選修3(6頁珍藏版)》請在裝配圖網(wǎng)上搜索�。
1、
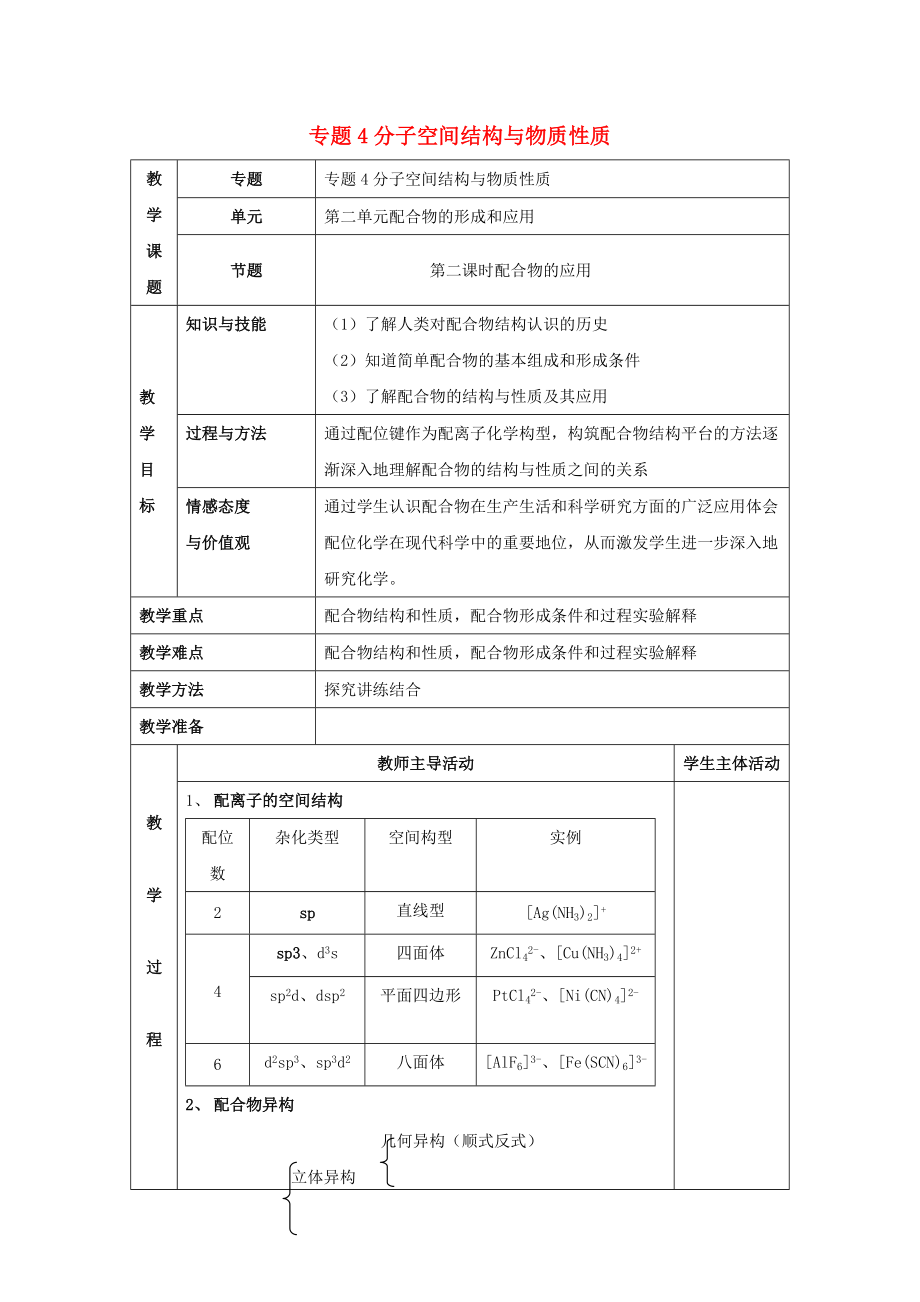
專題4分子空間結(jié)構(gòu)與物質(zhì)性質(zhì)
教學(xué)
課題
專題
專題4分子空間結(jié)構(gòu)與物質(zhì)性質(zhì)
單元
第二單元配合物的形成和應(yīng)用
節(jié)題
第二課時配合物的應(yīng)用
教學(xué)目標(biāo)
知識與技能
(1)了解人類對配合物結(jié)構(gòu)認(rèn)識的歷史
(2)知道簡單配合物的基本組成和形成條件
(3)了解配合物的結(jié)構(gòu)與性質(zhì)及其應(yīng)用
過程與方法
通過配位鍵作為配離子化學(xué)構(gòu)型�,構(gòu)筑配合物結(jié)構(gòu)平臺的方法逐漸深入地理解配合物的結(jié)構(gòu)與性質(zhì)之間的關(guān)系
情感態(tài)度
與價值觀
通過學(xué)生認(rèn)識配合物在生產(chǎn)生活和科學(xué)研究方面的廣泛應(yīng)用體會配位化學(xué)在現(xiàn)代科學(xué)中的重要地位,從而激發(fā)學(xué)生進(jìn)一步深入地研究化學(xué)�。
2、
教學(xué)重點
配合物結(jié)構(gòu)和性質(zhì)�,配合物形成條件和過程實驗解釋
教學(xué)難點
配合物結(jié)構(gòu)和性質(zhì),配合物形成條件和過程實驗解釋
教學(xué)方法
探究講練結(jié)合
教學(xué)準(zhǔn)備
教
學(xué)
過
程
教師主導(dǎo)活動
學(xué)生主體活動
1�、 配離子的空間結(jié)構(gòu)
配位數(shù)
雜化類型
空間構(gòu)型
實例
2
sp
直線型
[Ag(NH3)2]+
4
sp3、d3s
四面體
ZnCl42-�����、[Cu(NH3)4]2+
sp2d、dsp2
平面四邊形
PtCl42-�����、[Ni(CN)4]2-
6
d2sp3�、sp3d2
八面體
[AlF6]3-、[Fe(SC
3��、N)6]3-
2�、 配合物異構(gòu)
幾何異構(gòu)(順式反式)
立體異構(gòu)
配合物異構(gòu) 光學(xué)異構(gòu)
構(gòu)造異構(gòu)(電離、水合��、鍵合�����、配位�、聚合等)
觀察
理解
教
學(xué)
過
程
教師主導(dǎo)活動
學(xué)生主體活動
3、 配合物的性質(zhì)
有一定的穩(wěn)定性���,配位鍵越強�����,配合物越穩(wěn)定����。中心原子相同時,穩(wěn)定性取決于配位體����。
(1) 配位原子的電負(fù)性:電負(fù)性越弱,配合物越穩(wěn)定
(2) 配位體的堿性:堿
4���、性越強����,配合物越穩(wěn)定
三�、配合物的應(yīng)用
工業(yè)生產(chǎn)應(yīng)用(濕法冶金���、分離提純��、合成特殊功能分子)
定量分析應(yīng)用(檢驗離子特效試劑����、隱蔽劑�、有機沉淀劑����、
應(yīng)用 萃取分離)
合成應(yīng)用(催化劑�����、生物固氮)
生物體應(yīng)用: ����。
[課堂練習(xí)]
1、 請根據(jù)[Zn(NH3)4]2+中配位鍵的形成���,總結(jié)配位鍵的形成條件���?
2、 現(xiàn)有兩種配合物晶體和����,一種為橙黃色,另一種為紫紅色����。請設(shè)計實驗方案將這兩種配合物區(qū)別開來?
3�����、 寫出Ag(NH3)2OH的中心原子、配原子�����、配位數(shù)并寫出它電
5���、離的離子方程式�����?
某物質(zhì)的實驗式為PtCl4.2NH3�����,其水溶液不導(dǎo)電,加入AgNO3亦不產(chǎn)生沉淀����,以強堿處理并沒有NH3放出,寫出它的配位化學(xué)式�����?
[小結(jié)]配合物形成條件、結(jié)構(gòu)����、性質(zhì)、應(yīng)用����。
[作業(yè)]課后練習(xí)與實踐,第二課堂相關(guān)內(nèi)容
理解
板書
二����、配合物的結(jié)構(gòu)和性質(zhì)
1、配離子的空間結(jié)構(gòu)
2����、配合物的異構(gòu)
3、配合物的性質(zhì)
(1)配位原子電負(fù)性
(2)配位體的堿性
三��、配合物的應(yīng)用
練習(xí)
一�����、選擇題
1.下列屬于配合物的是 ( )
A.N
6�����、H3H2O B.Na2CO3.10H2O C.CuSO4. 5H2O D.Co(NH3)6Cl3
2.要證明某溶液中不含F(xiàn)e3+而可能含有Fe2+,進(jìn)行如下實驗操作時�,最佳順序為 ( )
①加入足量氯水 ②加入足量酸性高錳酸鉀溶液 ③加入少量NH4SCN溶液
A.①③ B.③② C.③① D.①②③
3.向下列配合物的水溶液中加入AgNO3溶液,不能生成白色沉淀的是 ( )
A�、[Co(NH3)4Cl2]Cl
7、 B����、[Co(NH3)3Cl3]
C、[Co(NH3)6]Cl3 D���、[Co(NH3)5Cl]Cl2
4.已知[Co(NH3)6]3+呈正八面體結(jié)構(gòu):各NH3分子間距相等�����,Co3+位于正八面的中心�。若其中二個NH3分子被Cl-取代����,所形成的[Co(NH2)4Cl2]+的同分異構(gòu)體的種數(shù) ( )
A 2種 B 3種 C 4種 D 5種
5.配合物在許多方面有著廣泛的應(yīng)用。下列敘述不正確的是 ( )
A.以Mg2+為中
8�、心的大環(huán)配合物葉綠素能催化光合作用
B.Fe2+的卟啉配合物是輸送O2的血紅素
C.[Ag(NH3)2]+是化學(xué)鍍銀的有效成分
D.向溶液中逐滴加入氨水��,可除去硫酸鋅溶液中的Cu2+
6.下列微粒:①H3O+②NH4+③CH3COO-④ NH3⑤CH4中含有配位鍵的是 ( )
A.①② B.①③ C.④⑤ D.②④
7.關(guān)于配位鍵的形成�,下列說法正確的是 ( )
A.提供電子對的原子一般要有孤對電子 B.接
9��、受電子對的原子一般要有空軌道
C.任意兩個原子間都可以形成配位鍵 D.配位鍵一般是單鍵�����,和普通單鍵性質(zhì)不同
8.已知信息:[Cu(NH3)4]SO4的電離方程式:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-�。具有6個配體的Co3+的配合物CoCl�mnNH3���,若1 mol此配合物與足量的AgNO3溶液反應(yīng)只生成1 mol AgCl沉淀�����,則m, n的值分別是 ( )
A.m=1, n=5 B.m=3, n=4 C.m=5, n=1 D.m=3,
10����、 n=3
二��、填空題
9.向CoCl2溶液中滴加氨水��,使生成的Co(OH)2沉淀溶解生成[Co(NH3)6]2+�����。此時向溶液中通入空氣,得到的產(chǎn)物中有一種其組成可用CoCl35NH3表示��。把分離出的CoCl35NH3溶于水后立即加硝酸銀溶液��,則析出AgCl沉淀���。經(jīng)測定�,每1mol CoCl35NH3只生成2mol AgCl����。請寫出表示此配合物結(jié)構(gòu)的化學(xué)式(鈷的配位數(shù)為6):___________,此配合物中Co的化合價為____ __���。
答案:[Co(NH3)5Cl]Cl2 +3
10.在白磷分子中�,每個磷原子以________________鍵與另外的________個磷原子相
11�、結(jié)合成__________________空間構(gòu)型,鍵角為________ ___�����。如果把一個白磷分子的每一個P-P都打開插入一個氧原子���,則一共可結(jié)合________個氧原子�����,這樣得到的化合物的分子式為__________�,若每個磷原子再以配位鍵結(jié)合一個氧原子�,則得到化合物的分子式為_____ __ ___。形成的配位鍵中����,________原子提供孤對電子,_________原子提供空軌道�����。
11.在含有Cu2+和NH3的水溶液中�,存在著三類化學(xué)反應(yīng),它們是(用配平的化學(xué)反應(yīng)方程式表示) ����、
12、 和 ���。如果pH值過高��,配離子濃度將 (填“升高”或“降低”)���;如果pH值過低��,配離子濃度將 (填“升高”或“降低”)���。
12. PtCl2(NH3)2可以形成兩種固體,一種為淡黃色����,在水中的溶解度小,另一種為黃綠色在水中的溶解度較大�����,請回答下列問題:
⑴PtCl2(NH3)2是平面正方形結(jié)構(gòu)���,還是四面體結(jié)構(gòu)
⑵ 請在以下空格內(nèi)畫出這兩種固體分子的幾何構(gòu)型圖���,淡黃色固體:
13、 ����,黃綠色固體:
⑶ 淡黃色固體物質(zhì)是由 分子組成,黃綠色固體物質(zhì)是由 分子組成(填“極性分子”或“非極性分子”)
⑷ 黃綠色固體在水中溶解度比淡黃色固體大�����,原因是
。
13.從金礦中提取金�����,傳統(tǒng)的方法是用氰化提金法���。氰化提金法的原理是:用稀的氰化鈉溶液處理粉碎了的金礦石,通入空氣���,使金礦中的金粒溶解����,生成能溶于水的物質(zhì)Na[A
14�����、u(CN)2]����。試寫出并配平金粒溶解的化學(xué)方程式 。然后再用鋅從溶液中把金置換出來��,試寫出并配平該化學(xué)方程式 。
9. [Co(NH3)5Cl]Cl2 +3
10.非極性共價��、三����、正四面體、600���、6��、P4O6���、P4O10、P��、O��。
11. Cu2+ +4H2O=[Cu(H2O)4]2+���、[Cu(H2O)4]2++ 4NH3=[Cu(NH3)4]2++ 4H2O
NH3?H2O =NH4++OH- 升高����、降低
⑷ 根據(jù)相似相溶原理����,因為淡黃色固體為非極性分子�,較難溶于極性溶劑水����;而黃綠色固體為極性分子,易溶于極性溶劑水�。
6EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F375
 高中化學(xué) 專題4 分子空間結(jié)構(gòu)與物質(zhì)性質(zhì) 4.2 配合物的應(yīng)用教案 蘇教版選修3
高中化學(xué) 專題4 分子空間結(jié)構(gòu)與物質(zhì)性質(zhì) 4.2 配合物的應(yīng)用教案 蘇教版選修3