《山東省濟(jì)寧市任城區(qū)九年級(jí)化學(xué)全冊(cè) 第二單元 常見(jiàn)的酸和堿 酸和堿的性質(zhì)(1)復(fù)習(xí)同步測(cè)試(無(wú)答案) 魯教版五四制》由會(huì)員分享����,可在線閱讀�,更多相關(guān)《山東省濟(jì)寧市任城區(qū)九年級(jí)化學(xué)全冊(cè) 第二單元 常見(jiàn)的酸和堿 酸和堿的性質(zhì)(1)復(fù)習(xí)同步測(cè)試(無(wú)答案) 魯教版五四制(5頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索。
1�、
酸和堿的性質(zhì)
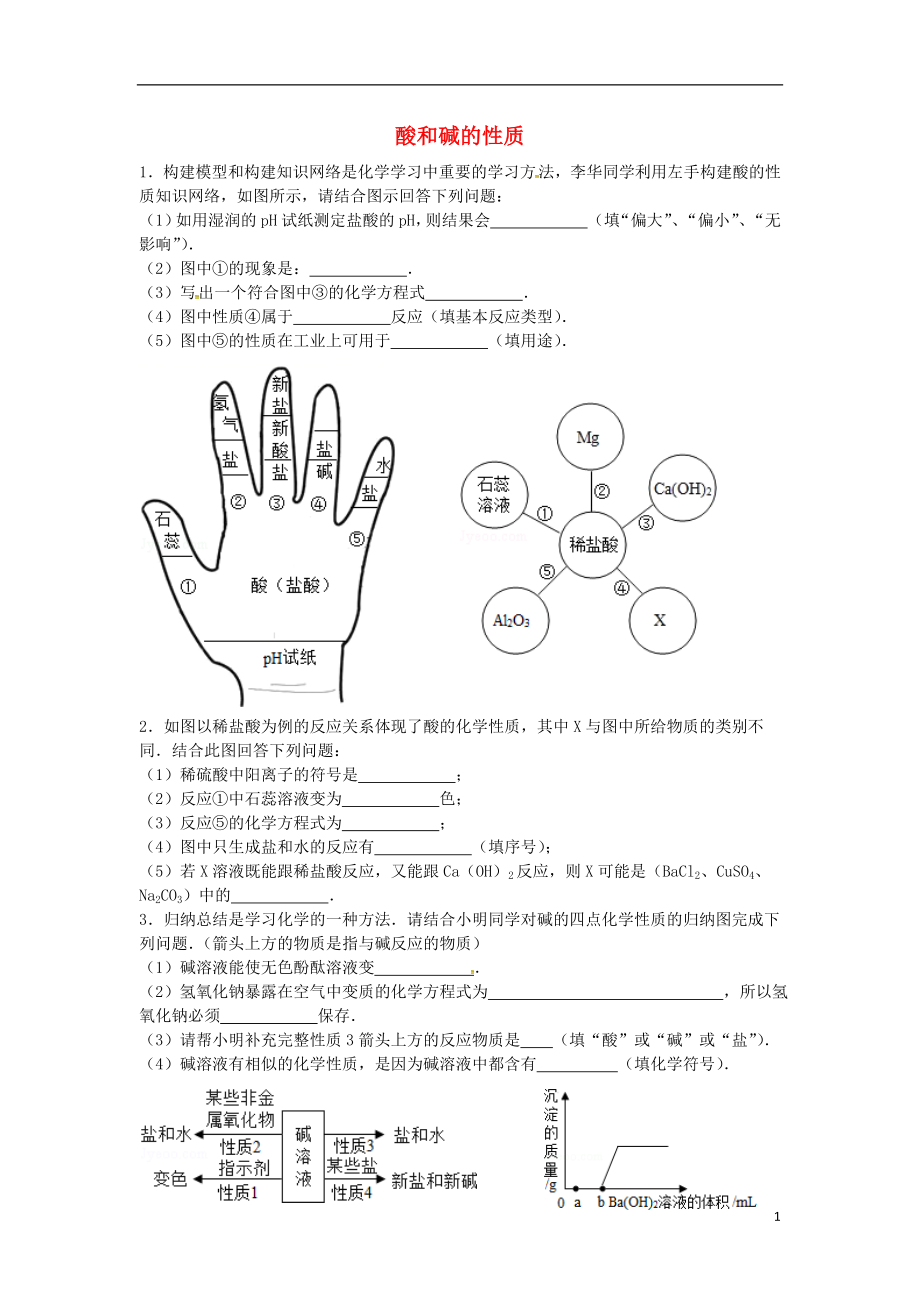
1.構(gòu)建模型和構(gòu)建知識(shí)網(wǎng)絡(luò)是化學(xué)學(xué)習(xí)中重要的學(xué)習(xí)方法,李華同學(xué)利用左手構(gòu)建酸的性質(zhì)知識(shí)網(wǎng)絡(luò)�����,如圖所示����,請(qǐng)結(jié)合圖示回答下列問(wèn)題:
(1)如用濕潤(rùn)的pH試紙測(cè)定鹽酸的pH,則結(jié)果會(huì) ?。ㄌ睢捌蟆薄ⅰ捌 ?�、“無(wú)影響”).
(2)圖中①的現(xiàn)象是: ?���。?
(3)寫(xiě)出一個(gè)符合圖中③的化學(xué)方程式 ?。?
(4)圖中性質(zhì)④屬于 反應(yīng)(填基本反應(yīng)類(lèi)型).
(5)圖中⑤的性質(zhì)在工業(yè)上可用于 ?。ㄌ钣猛荆?
2.如圖以稀鹽酸為例的反應(yīng)關(guān)系體現(xiàn)了酸的化學(xué)性質(zhì),其中X與圖中所給物質(zhì)的類(lèi)
2�、別不同.結(jié)合此圖回答下列問(wèn)題:
(1)稀硫酸中陽(yáng)離子的符號(hào)是 �;
(2)反應(yīng)①中石蕊溶液變?yōu)椤 ∩?
(3)反應(yīng)⑤的化學(xué)方程式為 �����;
(4)圖中只生成鹽和水的反應(yīng)有 ?�。ㄌ钚蛱?hào))����;
(5)若X溶液既能跟稀鹽酸反應(yīng),又能跟Ca(OH)2反應(yīng)����,則X可能是(BaCl2、CuSO4�����、Na2CO3)中的 .
3.歸納總結(jié)是學(xué)習(xí)化學(xué)的一種方法.請(qǐng)結(jié)合小明同學(xué)對(duì)堿的四點(diǎn)化學(xué)性質(zhì)的歸納圖完成下列問(wèn)題.(箭頭上方的物質(zhì)是指與堿反應(yīng)的物質(zhì))
(1)堿溶液能使無(wú)色酚酞溶液變 ?�。?
(2)氫氧化鈉暴露在空氣中變質(zhì)的化學(xué)方程式為
3��、 ����,所以氫氧化鈉必須 保存.
(3)請(qǐng)幫小明補(bǔ)充完整性質(zhì)3箭頭上方的反應(yīng)物質(zhì)是 (填“酸”或“堿”或“鹽”).
(4)堿溶液有相似的化學(xué)性質(zhì)�,是因?yàn)閴A溶液中都含有 (填化學(xué)符號(hào)).
4.某溶液由鹽酸���、稀硫酸、氫氧化鉀��、氯化鎂中的一種或幾種混合而成.現(xiàn)向該混合溶液中滴入氫氧化鋇溶液�����,產(chǎn)生沉淀質(zhì)量與加入氫氧化鋇溶液體積如圖所示.則:
(1)該溶液中一定沒(méi)有的溶質(zhì)是 ?��。?
(2)a點(diǎn)對(duì)應(yīng)的溶液中一定含有的溶質(zhì)是 ?����。?
16.如圖表示五種不同類(lèi)別物質(zhì)間的關(guān)系.A是鐵銹的主要成分��,C俗稱(chēng)苛性鈉��,請(qǐng)結(jié)合圖示回答
4��、問(wèn)題.(圖中“﹣”表示相連的兩種物質(zhì)能發(fā)生反應(yīng)�,“→”表示一種物質(zhì)能轉(zhuǎn)化成另一種物質(zhì))
(1)A物質(zhì)的化學(xué)式是 ,B物質(zhì)是 ?�。?
(2)C物質(zhì)的另一個(gè)俗稱(chēng)是 ?��。苡谒畷r(shí)會(huì)出現(xiàn) ?���。ㄌ睢胺艧帷被颉拔鼰帷保┈F(xiàn)象.
(3)在①���、②�����、③���、④四個(gè)反應(yīng)中����,不能體現(xiàn)酸的化學(xué)通性的是 ?�。ㄌ钚蛱?hào)).
5.酸和堿的知識(shí)是九年級(jí)化學(xué)學(xué)習(xí)的重要知識(shí).請(qǐng)回答下列有關(guān)問(wèn)題:
(1)下列說(shuō)法中不正確的是 ?�。ㄌ钭帜复?hào))
a.酸和堿都含有氫元素 b.生成鹽和水的反應(yīng)一定是中和反應(yīng)
c.多數(shù)酸和堿有腐蝕性 d.酸和堿能與所有的鹽發(fā)生復(fù)
5�����、分解反應(yīng)
(2)為探究酸����、堿的化學(xué)性質(zhì),某小組做了如圖所示實(shí)驗(yàn).
①實(shí)驗(yàn)后某試管中為紅色溶液�����,向其中加入一定量的某溶液后��,紅色消失變?yōu)闊o(wú)色��,則此時(shí)溶液的pH 7.該反應(yīng)的化學(xué)方程式為 ?����。?
②實(shí)驗(yàn)結(jié)束后�����,將得到的藍(lán)色溶液和無(wú)色溶液倒入同一個(gè)干凈的燒杯中�����,可觀察到有藍(lán)色沉淀生成�����,請(qǐng)解釋其原因�����?
(3)某敞口放置的氫氧化鈉溶液已變質(zhì)�,用方程式表示其變質(zhì)的原因.
為證明該瓶氫氧化鈉溶液未完全變質(zhì),設(shè)計(jì)了以下實(shí)驗(yàn)����,請(qǐng)將表格填寫(xiě)完整.
實(shí)驗(yàn)操作
現(xiàn)象
結(jié)論或化學(xué)方程式
取少量該樣品,滴加足量的某溶液�����,充分反應(yīng)后過(guò)濾
有白色沉淀生成
有關(guān)反應(yīng)的化學(xué)方程式為
①
6、
在濾液中滴加酚酞溶液
②
樣品未完全變質(zhì)�,仍含有氫氧化鈉
(4)取已變質(zhì)的氫氧化鈉溶液100g,向其中加入溶質(zhì)質(zhì)量分?jǐn)?shù)為7.3%的稀鹽酸100g�,恰好完全反應(yīng)得到中性溶液.試計(jì)算蒸干該溶液可得到固體的質(zhì)量.
6.酸、堿��、鹽在生活�����、生產(chǎn)中應(yīng)用廣泛�,使用時(shí)必須十分小心,氫氧化鈉具有強(qiáng)烈的 ��,實(shí)驗(yàn)時(shí)最好戴防護(hù)眼鏡���,為了便于理解和記憶����,小麗同學(xué)總結(jié)了堿的化學(xué)性質(zhì)如圖����,請(qǐng)你根據(jù)要求完成下列問(wèn)題:
(1)小麗同學(xué)發(fā)現(xiàn)����,以前取用氫氧化鈉溶液時(shí)試劑瓶忘記蓋瓶塞���,依據(jù)反應(yīng)③說(shuō)明NaOH必須密封保存,否則在空氣中要變質(zhì)�,如果該溶液變質(zhì),則發(fā)生反應(yīng)的化
7����、學(xué)方程式為 �����;
(2)要檢驗(yàn)該氫氧化鈉溶液已變質(zhì)�,選擇下列試劑不能達(dá)到目的是 .
A.稀HCl B.酚酞試液 C.CaCl2 D.Ca(OH)2
(3)為了驗(yàn)證反應(yīng)④���,小麗將無(wú)色酚酞試液分別滴入NaOH溶液和澄清石灰水中�,溶液由無(wú)色變成紅色�,原因是它們?cè)谒芤褐心茈婋x出 .
(4)依據(jù)反應(yīng)②�,KOH能與下列物質(zhì)反應(yīng)的是 ;
A.H2SO4 B.BaCl2 C.CuSO4 D.Na2CO3
發(fā)生反應(yīng)的化學(xué)方程式為: ?���。?
7.在實(shí)驗(yàn)室,某同學(xué)將氫氧化鈉溶液逐滴滴入硫酸和硫酸銅的混合溶液中�����,直至過(guò)量
8�、.加入氫氧化鈉溶液的質(zhì)量(橫軸)與混合溶液中溶質(zhì)質(zhì)量(縱軸)的關(guān)系如圖所示.
(1)實(shí)驗(yàn)中,觀察到的現(xiàn)象為 .
(2)實(shí)驗(yàn)中發(fā)生反應(yīng)的化學(xué)方程式有 .
(3)圖中B→C線段對(duì)應(yīng)溶質(zhì)質(zhì)量減小的本質(zhì)原因是 .
(4)向反應(yīng)后的溶液中加入適量BaCl2溶液�����,恰好完全反應(yīng)后溶液中的溶質(zhì)有 ?�。?
8.為探究氫氧化鈣溶液和稀鹽酸反應(yīng)所得溶液中溶質(zhì)的成分���,小鳴和同學(xué)們通過(guò)測(cè)定了反應(yīng)后溶液的pH�,得到了如圖所示的pH曲線�����,請(qǐng)回答:
(1)由圖可知該實(shí)驗(yàn)操作是將 滴加到另一種溶液中����;
(2
9、)該反應(yīng)的化學(xué)方程式為 ?。?
(3)實(shí)驗(yàn)過(guò)程中���,小鳴取了a�����、b�、c三處反應(yīng)后的溶液于三個(gè)燒杯中�,卻忘了作標(biāo)記,請(qǐng)你設(shè)計(jì)不同的方案(不再用測(cè)定pH的方法)�,探究三種樣品分別屬于哪處溶液.
【查閱資料】CaCl2溶液顯中性,CaCl2+Na2CO3=CaCO3↓+2NaCl.
【探究過(guò)程】
①分別取少量樣品于三支試管中�,加入酚酞試液,觀察到其中一支試管內(nèi)出現(xiàn) 的現(xiàn)象.結(jié)論:該樣品是a處溶液.
②為進(jìn)一步確定b或c處溶液����,又設(shè)計(jì)了以下方案:
實(shí)驗(yàn)步驟
實(shí)驗(yàn)現(xiàn)象
實(shí)驗(yàn)結(jié)論
另取余下樣品少量于兩支試管中,分別滴加足量的Na2CO3溶液.
該樣品為b處
10����、溶液.
該樣品為c處溶液,并推知溶液中的陽(yáng)離子有 .
【反思評(píng)價(jià)】探究反應(yīng)后溶液中溶質(zhì)的成分�,除了要考慮生成物之外,還要考慮 ?���。?
9.為了探究中和反應(yīng),甲����、乙兩名同學(xué)分別進(jìn)行以下實(shí)驗(yàn).
(1)甲同學(xué)向裝有少量Ca(OH)2溶液的試管中倒入一定量的稀鹽酸,然后滴加幾滴酚酞試液��,發(fā)現(xiàn)酚酞不變色����,此現(xiàn)象 (填“能”或“不能”)說(shuō)明鹽酸與氫氧化鈣發(fā)生了反應(yīng).
(2)乙同學(xué)向滴有酚酞的NaOH溶液中逐滴加入稀鹽酸�����,邊滴加邊振蕩�,“振蕩”的目的是 ,在滴加過(guò)程中�,乙同學(xué)意外發(fā)現(xiàn)有氣泡產(chǎn)生,通過(guò)思考認(rèn)為該氫氧化鈉溶液已變質(zhì)��,變質(zhì)的原因是
11、
(用化學(xué)方程式表示).
(3)乙同學(xué)為了檢驗(yàn)該氫氧化鈉溶液的變質(zhì)程度��,設(shè)計(jì)實(shí)驗(yàn)方案并得出結(jié)論.
實(shí)驗(yàn)操作
實(shí)驗(yàn)現(xiàn)象
實(shí)驗(yàn)結(jié)論
取樣于試管中�,先滴加 ��,
再滴加 ?����。?
氫氧化鈉溶液
部分變質(zhì)
(4)實(shí)驗(yàn)結(jié)束后�,甲、乙兩名同學(xué)將三支試管中的廢液倒入同一潔凈燒杯中��,得到無(wú)色澄清溶液����,分析所得溶液中溶質(zhì)的成分為 .
10.如圖是甲��、乙兩位同學(xué)一起在實(shí)驗(yàn)室進(jìn)行的氫氧化鈉與鹽酸中和反應(yīng)的實(shí)驗(yàn).
(說(shuō)明:圖中A1��、A2����、A3��、B1��、B2�、B3均為溶液編號(hào))
12��、
根據(jù)圖中實(shí)驗(yàn)���,請(qǐng)你與甲��、乙同學(xué)一起完成下列探究:
探究環(huán)節(jié)
甲同學(xué)的探究
乙同學(xué)的探究
提出問(wèn)題
A3溶液為什么不變紅���?
B3溶液中溶質(zhì)成分是什么?(酚酞不計(jì))
做出猜想
實(shí)驗(yàn)過(guò)程中���,酚酞變質(zhì)了����?
猜想一:NaCl 猜想二:NaCl HCl
實(shí)驗(yàn)驗(yàn)證
(1)取少量A3溶液于另一試管中��,向其中滴加NaOH溶液���,溶液變紅���,說(shuō)明甲同學(xué)的猜想 ?��。ㄌ睢俺闪ⅰ被颉安怀闪ⅰ保?
(2)你認(rèn)為,在常溫下A2溶液測(cè)出的pH 應(yīng) ?。ㄌ睢埃尽薄ⅰ?”或“<”)7
取少量B2溶液加入盛有少量鐵粉的試管中���,觀察到有無(wú)色氣泡產(chǎn)生,固體逐漸減少�,溶液由無(wú)色變 ,據(jù)此����,你認(rèn)為乙同學(xué)的猜想 (填“一”或“二”)成立
交流反思
(1)甲�、乙同學(xué)的實(shí)驗(yàn)中,反應(yīng)均涉及到的化學(xué)方程式是 .
(2)A3溶液未變紅�,你認(rèn)為原因是A2溶液中 較多,加入的NaOH溶液未將其完全中和.
(3)甲����、乙同學(xué)經(jīng)過(guò)實(shí)驗(yàn)對(duì)比探究,一致認(rèn)為做化學(xué)實(shí)驗(yàn)時(shí)應(yīng)注意藥品用量的控制.
5
 山東省濟(jì)寧市任城區(qū)九年級(jí)化學(xué)全冊(cè) 第二單元 常見(jiàn)的酸和堿 酸和堿的性質(zhì)(1)復(fù)習(xí)同步測(cè)試(無(wú)答案) 魯教版五四制
山東省濟(jì)寧市任城區(qū)九年級(jí)化學(xué)全冊(cè) 第二單元 常見(jiàn)的酸和堿 酸和堿的性質(zhì)(1)復(fù)習(xí)同步測(cè)試(無(wú)答案) 魯教版五四制