《高效課堂寶典訓練九年級化學上冊 第3單元 課題2 原子的結(jié)構(gòu)課件2 (新版)新人教版》由會員分享����,可在線閱讀,更多相關(guān)《高效課堂寶典訓練九年級化學上冊 第3單元 課題2 原子的結(jié)構(gòu)課件2 (新版)新人教版(25頁珍藏版)》請在裝配圖網(wǎng)上搜索�。
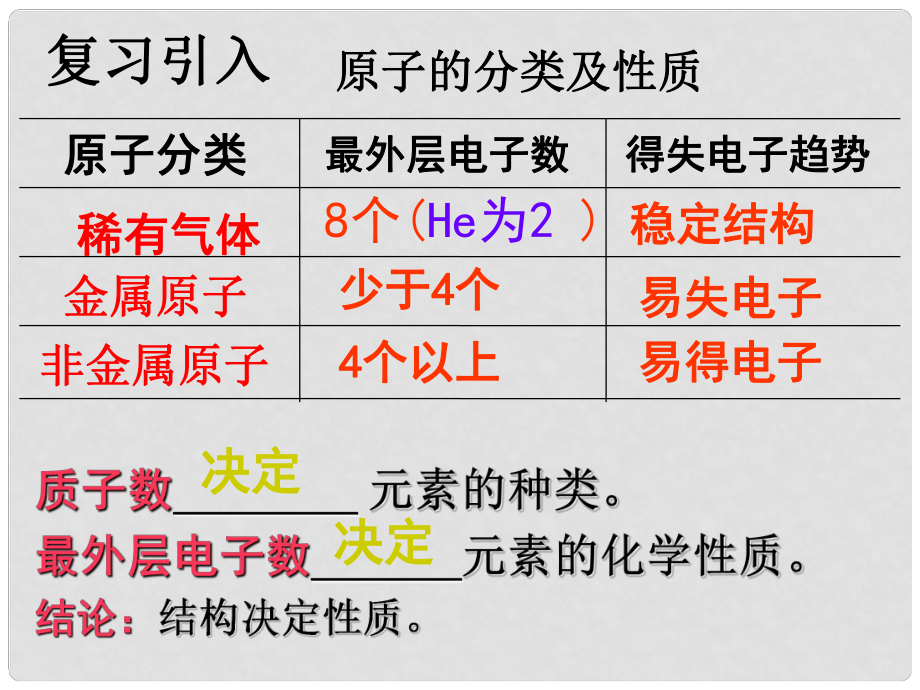
1、非金屬原子非金屬原子金屬原子金屬原子稀有氣體稀有氣體得失電子趨勢得失電子趨勢最外層電子數(shù)最外層電子數(shù)原子分類原子分類8個(He為2 )少于少于4 4個個4 4個以上個以上穩(wěn)定結(jié)構(gòu)穩(wěn)定結(jié)構(gòu)易失電子易失電子 易得電子易得電子決定決定決定決定原子的分類及性質(zhì)原子的分類及性質(zhì)復(fù)習引入復(fù)習引入 由于由于金屬原子金屬原子�����、非金屬原子非金屬原子的原子核外最外層沒有達到穩(wěn)的原子核外最外層沒有達到穩(wěn)定結(jié)構(gòu)�,定結(jié)構(gòu),在化學反應(yīng)中容易得在化學反應(yīng)中容易得失電子����,從而達到穩(wěn)定結(jié)構(gòu)失電子,從而達到穩(wěn)定結(jié)構(gòu)����,那么�,得失電子的結(jié)果怎樣呢�?那么,得失電子的結(jié)果怎樣呢�? 1了解離子的形成過程及離子的表示方法,認識離子也是構(gòu)成物
2�����、質(zhì)的一種粒子����,初步形成“物質(zhì)的粒子性”的觀點 2了解相對原子質(zhì)量的意義鈉原子結(jié)構(gòu)示意圖鈉原子結(jié)構(gòu)示意圖知識回顧知識回顧鈉和氯的原子結(jié)構(gòu)示意圖鈉和氯的原子結(jié)構(gòu)示意圖+11281Na+17287Cl 請同學們小組內(nèi)討論,請同學們小組內(nèi)討論����,鈉原子鈉原子和氯原子形成氯化鈉的過程和氯原子形成氯化鈉的過程�����,并用����,并用生動�����、形象的方式展示出來����。生動�、形象的方式展示出來。學學生生活活動動+112 8 1Na+172 8 7Cl+1728 8Cl-+112 8Na+Na+Cl-陽離子陽離子陰離子陰離子氯化鈉氯化鈉(NaCl)的形成過程的形成過程化合物化合物1個個e離子:帶電荷的原子�。離子:帶電荷的原子。陽離子
3�、:帶正電荷的原子陽離子:帶正電荷的原子陰離子:帶負電荷的原子陰離子:帶負電荷的原子Na+Al3+s2-Cl-離子離子離子也是構(gòu)成物質(zhì)的一種粒子。離子也是構(gòu)成物質(zhì)的一種粒子�。Xn n元素符號元素符號離子所帶電荷數(shù)(得失電子離子所帶電荷數(shù)(得失電子數(shù);數(shù)����;當當n=時略去不寫時略去不寫 )離子帶正或負電離子帶正或負電4 4、離子的表示�����、離子的表示離子符號(離子符號(P55P55)5 5�、離子符號的意義、離子符號的意義(P55P55)(1) 表示氧元素的一個離子表示氧元素的一個離子(2) 表示帶表示帶2個單位的負電荷的氧離子個單位的負電荷的氧離子(3) 表示氧離子帶表示氧離子帶2個單位的負電荷個單位的
4����、負電荷( (數(shù)字的數(shù)字的意義意義) )例:例: O2-一個鎂離子鎂離子帶2個單位的正電荷�。3Mg2+表示3個鎂離子Mg2+練一練練一練1.1.原子和陰原子和陰, ,陽離子之間是怎樣相互轉(zhuǎn)化的陽離子之間是怎樣相互轉(zhuǎn)化的? ?2.2.原子與離子之間有什么區(qū)別和聯(lián)系原子與離子之間有什么區(qū)別和聯(lián)系? ?失電子失電子得電子得電子得電子得電子失電子失電子陰離子陰離子陽離子陽離子 原子原子 原子原子不帶不帶電電, ,而離子而離子帶帶電電 區(qū)別區(qū)別 原子原子一般不一般不具有穩(wěn)定結(jié)構(gòu)具有穩(wěn)定結(jié)構(gòu), ,而離子而離子具有具有穩(wěn)定結(jié)構(gòu)穩(wěn)定結(jié)構(gòu) 離子是由原子得失電子形成離子是由原子得失電子形成 聯(lián)系聯(lián)系 都都能構(gòu)成物質(zhì)
5����、能構(gòu)成物質(zhì), ,保持物質(zhì)化學性質(zhì)保持物質(zhì)化學性質(zhì) 想一想想一想 通過今天的學習,通過今天的學習�,你有哪些收獲?你有哪些收獲�? 問一問問一問 你對所學的知識你對所學的知識還存有哪些疑問?還存有哪些疑問�? 說一說說一說 你還想了解哪你還想了解哪些有關(guān)知識?些有關(guān)知識�����? 1.下列粒子表示帶下列粒子表示帶2單位正電荷陽離子是單位正電荷陽離子是 2.一種元素的原子變成離子時一種元素的原子變成離子時( )+10+102 28 8+11+112 28 8+12+122 28 8+13+132 28 8A AB BC CD DC C( )( ) A. A.一定失去電子一定失去電子 B.B.一定得到電子一定得到
6�����、電子 C. C.電子層一定變化電子層一定變化 D.D.得失電子都可能得失電子都可能D D練一練練一練 3.由下面的卡通圖分析得出的結(jié)論錯誤的是( )A.鈉原子在化學反應(yīng)中容易失去電子 B.鈉原子與鈉離子都不顯電性C.氯原子得一個電子形成氯離子 D.氯化鈉由氯離子和鈉離子構(gòu)成B B練一練練一練一����、構(gòu)成原子的粒子的電性和質(zhì)量一�����、構(gòu)成原子的粒子的電性和質(zhì)量電性電性質(zhì)量質(zhì)量1個單位正電荷個單位正電荷1.672610-27kg不帶電不帶電1.674910-27kg1個單位負電荷個單位負電荷質(zhì)子質(zhì)量的質(zhì)子質(zhì)量的1/1836一個質(zhì)子和一個電子所帶的電量相等,電性相反�。一個質(zhì)子和一個電子所帶的電量相等,電性相
7����、反。一個質(zhì)子和一個中子的質(zhì)量約相等�。一個質(zhì)子和一個中子的質(zhì)量約相等。原子的質(zhì)量主要集中在原子核上�。原子的質(zhì)量主要集中在原子核上。原子質(zhì)量原子質(zhì)量 原子核質(zhì)量原子核質(zhì)量= =質(zhì)子質(zhì)量質(zhì)子質(zhì)量+ +中子質(zhì)量中子質(zhì)量粒子種類粒子種類質(zhì)子質(zhì)子中子中子電子電子知識點知識點2 相對原子質(zhì)量 一個氫原子的質(zhì)量是:一個氫原子的質(zhì)量是: 1.671.671010-27-27 一個氧原子的質(zhì)量是:一個氧原子的質(zhì)量是: 2.6572.6571010-26-26 一個碳原子的質(zhì)量是一個碳原子的質(zhì)量是 1.9931.9931010-26-26 千克千克000000000000000000000000001993 千克千
8����、克原子的質(zhì)量如此小,無論書寫�、記憶、還是使原子的質(zhì)量如此小�����,無論書寫�、記憶、還是使 用都極不方便����。原子的質(zhì)量又該怎樣衡量呢�����?用都極不方便�。原子的質(zhì)量又該怎樣衡量呢�����? 知識點知識點2 相對原子質(zhì)量 : 國國 際際 上上 一一 致致 同同 意意 以以 一一 種種 碳碳 原原 子子 質(zhì)質(zhì) 量量 的的1/121/12作作 為為 標標 準準, , 其其 他他 原原 子子 的的 質(zhì)質(zhì) 量量 跟跟 它它 比比 較較 所所 得得 的的 比比, , 作為作為 這這 種種 原原 子子 的的 相相 對對 原原 子子 質(zhì)質(zhì) 量�。量。二�����、相對原子質(zhì)量二�����、相對原子質(zhì)量知識點知識點2 相對原子質(zhì)量(P56) 2.2.定義式
9����、定義式: : 原子的實際質(zhì)量原子的實際質(zhì)量(kg)(kg)某原子的相對原子質(zhì)量某原子的相對原子質(zhì)量 = = 碳原子的實際質(zhì)量碳原子的實際質(zhì)量 (kg)(kg) 1/121/12注意:注意:相對原子質(zhì)量相對原子質(zhì)量 實際質(zhì)量,只是實際質(zhì)量�����,只是一個一個 ����, 單位。單位�����。不是不是比值比值一般不寫一般不寫知識點知識點2 相對原子質(zhì)量(P56) 已知:氧原子的質(zhì)量已知:氧原子的質(zhì)量2.6572.657 二�、相對原子質(zhì)量(二、相對原子質(zhì)量(P56P56) 觀察和比較每一組數(shù)據(jù)的關(guān)系:觀察和比較每一組數(shù)據(jù)的關(guān)系:1 11 11212161623236 68 811116 68 812120 0相對原子質(zhì)量
10�、相對原子質(zhì)量質(zhì)子數(shù)質(zhì)子數(shù) 中子數(shù)中子數(shù)0 0相對原子質(zhì)量的近似值與質(zhì)子數(shù)、中子數(shù)的關(guān)系相對原子質(zhì)量的近似值與質(zhì)子數(shù)�����、中子數(shù)的關(guān)系二�����、相對原子質(zhì)量(二�����、相對原子質(zhì)量(P56P56)原子原子種類種類原子核原子核相對原相對原子質(zhì)量子質(zhì)量 核外核外電子數(shù)電子數(shù)質(zhì)子數(shù)質(zhì)子數(shù) 中子數(shù)中子數(shù)氫氫11碳碳66鈉鈉1112鐵鐵 56 261 1、填寫表格����、填寫表格0 01 16 612122323111126263030練一練練一練2 2 鐵原子的相對原子質(zhì)量是鐵原子的相對原子質(zhì)量是( )( )A 56A 56克克 B 56 B 56 C 9.288 C 9.288 10 10-26-26 Kg D 1/56
11、Kg D 1/56B B練一練練一練 3����、1克鐵、克鐵����、1克鎂和克鎂和1克銅,所含原子數(shù)克銅����,所含原子數(shù)目最多的是(目最多的是( ),最少的是()�,最少的是( ) 4、已知�����、已知A�����、B、C三種原子的相對原子質(zhì)三種原子的相對原子質(zhì)量之比為量之比為1:2:3����,則相同數(shù)目的三種原子�,則相同數(shù)目的三種原子,它們的質(zhì)量比為(它們的質(zhì)量比為( )����。取質(zhì)量相)。取質(zhì)量相同的三種原子����,它們的原子數(shù)目比同的三種原子,它們的原子數(shù)目比 為為( )鎂鎂銅銅 3:2:11:2:3練一練練一練5.下列微粒的性質(zhì)與質(zhì)子數(shù)����、電子數(shù)、下列微粒的性質(zhì)與質(zhì)子數(shù)����、電子數(shù)、中子數(shù)�、電子層數(shù)、最外層電子數(shù)等有中子數(shù)、電子層數(shù)����、最外層電子數(shù)等有關(guān),請你用它們填空關(guān)�����,請你用它們填空 原子種類原子種類_����; 元素分類元素分類_; 相對原子質(zhì)量相對原子質(zhì)量 _�����; 元素的化學性質(zhì)元素的化學性質(zhì) _�����; 離子所帶電荷離子所帶電荷_�; 質(zhì)子數(shù)質(zhì)子數(shù)最外層電子數(shù)最外層電子數(shù)質(zhì)子數(shù)、中子數(shù)質(zhì)子數(shù)�����、中子數(shù)最外層電子數(shù)最外層電子數(shù)最外層電子數(shù)最外層電子數(shù)練一練練一練1 1、什么是離子�����?�����、什么是離子����?2 2�、離子的形成?����、離子的形成?3 3�����、離子與原子的區(qū)別和聯(lián)系�����、離子與原子的區(qū)別和聯(lián)系 4、離子的表示方法����,意義。�����、離子的表示方法�,意義。5�����、相對原子質(zhì)量����、相對原子質(zhì)量課堂小結(jié)課堂小結(jié)
 高效課堂寶典訓練九年級化學上冊 第3單元 課題2 原子的結(jié)構(gòu)課件2 (新版)新人教版
高效課堂寶典訓練九年級化學上冊 第3單元 課題2 原子的結(jié)構(gòu)課件2 (新版)新人教版